
 Ⅰ時,反應物A的轉(zhuǎn)化率a(A)=60%.x:y=1:2.
Ⅰ時,反應物A的轉(zhuǎn)化率a(A)=60%.x:y=1:2.分析 (1)A是反應物,10 min內(nèi)其濃度減小量為(1.0-0.6)mol•L-1,則平均反應速率=$\frac{△c}{△t}$計算得到,10 min時C的濃度增加0.40 mol•L-1,平衡狀Ⅰ時A濃度減少1.0mol/L-0.4mol/L=0.6mol/L,C濃度增大為1.2mol/L,A的起始濃度=1mol/L,容器體積為2L,轉(zhuǎn)化率=$\frac{消耗量}{起始量}$×100%,則C與A的濃度變化之比是2:1,即x:y=1:2;
(2)恒溫下反應10min后突然改變某一條件C增大,A減小的速率增大,x:y=1:2,可以是1,2;2,4,得到反應前后的氣體物質(zhì)的量變化不同,可能增加、減小或不變,18min時升高溫度,C物質(zhì)的量濃度減小,A濃度增大,說明平衡逆向進行;
(3)根據(jù)圖象知10 min時反應速率加快,恒溫下反應10min后突然改變某一條件C增大,A減小的速率增大,依據(jù)影響反應速率和反應正向進行的反應方向分析判斷選項;
(4)若已知平衡狀態(tài)Ⅰ時B的物質(zhì)的量為0.6mol,則可以依據(jù)消耗的反應物和增大的生成物物質(zhì)的量之比計算得到計量數(shù)之比,寫出化學方程式,依據(jù)化學平衡三段式列式計算平衡濃度,平衡常數(shù)K1=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;已知第18min時改變的條件是升高溫度,而該反應是放熱反應,所以升高溫度平衡逆移,則平衡常數(shù)減小,若已知平衡狀態(tài)Ⅰ時B的物質(zhì)的量為0.6mol.
解答 解:(1)A是反應物,10 min內(nèi)其濃度減小量為(1.0-0.6)mol•L-1=0.4mol/L,v(A)=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min),圖象分析可知反應的物質(zhì)的量之比等于化學計量數(shù)之比得知,平衡狀Ⅰ時A濃度減少1.0mol/L-0.4mol/L=0.6mol/L,C濃度增大為1.2mol/L,A的起始濃度=1mol/L,容器體積為1L,轉(zhuǎn)化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.6mol/L}{1mol/L}$×100%=60%,消耗量之比等于化學方程式計量數(shù)之比,則C與A的濃度變化之比是2:1,即x:y=1:2
故答案為:0.04mol/(L•min),60%,1:2;
(2)恒溫下反應10min后突然改變某一條件C增大,A減小的速率增大,x:y=1:2,可以是1,2,化學方程式為A(g)+2B(g)?2C(g),反應前后氣體物質(zhì)的量減小,若為2,4,化學方程式為:2A(g)+2B(g)?4C(g),反應前后氣體物質(zhì)的量不變,若為3,6,則得到化學方程式為:3A(g)+2B(g)?6C(g),反應前后氣體物質(zhì)的量增大,得到反應前后的氣體物質(zhì)的量變化不同,可能增加、減小或不變,平衡狀態(tài)Ⅰ與起始狀態(tài)的壓強相比較,是不能確定的,無法確定,18min時升高溫度,圖象分析可知,C物質(zhì)的量濃度減小,A濃度增大,說明平衡逆向進行,正反應為放熱反應,
故答案為:無法判斷,放熱;
(3)l0min后化學反應速率加快了直到到達化學平衡狀態(tài),A濃度減小,C濃度增大達到平衡狀態(tài)Ⅰ,上述分析可知反應為放熱反應,
①減壓反應速率減小,故①錯誤;
②降溫反應速率減小,不符合圖象變化,故②錯誤;
③升溫反應速率增大,反應未達到平衡狀態(tài),所以反應仍正向進行最后達到平衡狀態(tài)Ⅰ,故③正確;
④加催化劑 加快反應速率,故④正確;
⑤增加B的量是增大反應物濃度,反應速率增大,故⑤正確;
⑥恒溫恒容容器中充入氦氣,總壓增大,分壓不變,速率不變,故⑥錯誤;
所以反應條件可能為選③④⑤.
故答案為:③④⑤;
(4)向恒容密閉容器中充入2.0molA和3.0molB,發(fā)生反應xA(g)+2B(g)?yC(g).A的起始濃度=1mol/L,容器體積為2L,若已知平衡狀態(tài)Ⅰ時B的物質(zhì)的量為0.6mol,消耗B物質(zhì)的量為3.0mol-0.6mol=2.4mol,A消耗物質(zhì)的量=2.0mol-0.4mol/L×2L=1.2mol,C生成物質(zhì)的量=2L×1.2mol/L=2.4mol,化學方程式計量數(shù)之比=1.2:2.4:2.4=1:2:2,化學方程式為:A(g)+2B(g)?2C,
平衡濃度分別為:c(A)=0.4mol/L,c(B)=$\frac{0.6mol}{2L}$=0.3mol/L,c(C)=1.2mol/L
平衡常數(shù)K1=$\frac{1.{2}^{2}}{0.4×0.{3}^{2}}$=40L/mol,
已知第18min時改變的條件是升高溫度,而該反應是放熱反應,所以升高溫度平衡逆移,則平衡常數(shù)減小,所以K1>K2,
故答案為:40L/mol,>.
點評 本題考查反應速率、平衡常數(shù)計算、平衡移動等,難度中等,考查學生對基礎知識的掌握程度,掌握基礎是關鍵.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
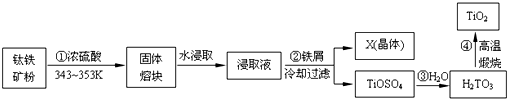
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質(zhì) | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
| 實驗步驟 | 實驗現(xiàn)象 | 實驗結論 |
| ① | 溶液X中含有Na+ | |
| ② | 溶液X中含有Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
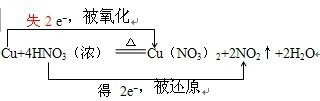 .
.查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com