
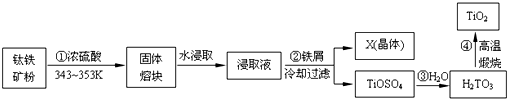
分析 鈦鐵礦(主要成分FeTiO3,含F(xiàn)e2O3、SiO2等雜質(zhì))加入濃硫酸加熱反應(yīng)得到固體熔塊,加入水水浸,得到浸取液中加入鐵屑防止亞鐵離子被氧化為鐵離子,過濾得到X晶體為為綠礬(FeSO4•7H2O)晶體和濾液TiOSO4,加入水反應(yīng)生成H2TiO3,高溫煅燒得到二氧化鈦.
(1)鈦鐵礦主要成分FeTiO3與濃硫酸反應(yīng)的主要產(chǎn)物是TiOSO4和FeSO4,結(jié)合原子守恒配平書寫化學(xué)方程式;
(2)為提高“固體熔塊”水浸取時的浸出率可以連續(xù)攪拌,升高溫度,循環(huán)浸取、延長時間、熔塊粉碎等;
(3)亞鐵離子易被空氣中氧氣氧化為鐵離子,避免亞鐵離子被氧化且不引入雜質(zhì),加入鐵屑可以防止亞鐵離子被氧化;
(4)根據(jù)過濾操作的原理、使用的儀器進行分析解答;
(5)第③步反應(yīng)是TiOSO4加入水反應(yīng)生成H2TiO3和硫酸的反應(yīng).
解答 解:鈦鐵礦(主要成分FeTiO3,含F(xiàn)e2O3、SiO2等雜質(zhì))加入濃硫酸加熱反應(yīng)得到固體熔塊,加入水水浸,得到浸取液中加入鐵屑防止亞鐵離子被氧化為鐵離子,過濾得到X晶體為為綠礬(FeSO4•7H2O)晶體和濾液TiOSO4,加入水反應(yīng)生成H2TiO3,高溫煅燒得到二氧化鈦.
(1)鈦鐵礦主要成分FeTiO3與濃硫酸反應(yīng)的主要產(chǎn)物是TiOSO4和FeSO4,結(jié)合原子守恒配平書寫化學(xué)方程式為:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,
故答案為:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(2)為提高“固體熔塊”水浸取時的浸出率,適宜的條件可以選擇,連續(xù)攪拌能加快水分子運動速度,升高溫度,循環(huán)浸取、延長時間、熔塊粉碎等,
故答案為:熔塊粉碎(或連續(xù)攪拌、適當(dāng)升高溫度等);
(3)亞鐵離子易被空氣中氧氣氧化為鐵離子,避免亞鐵離子被氧化且不引入雜質(zhì),加入鐵屑可以防止亞鐵離子被氧化,2Fe3++Fe=3Fe2+,
故答案為:2Fe3++Fe=3Fe2+;防止Fe2+被氧化;
(4)過濾中用到的儀器有:鐵架臺、玻璃棒、燒杯、漏斗等,其中用到的三種玻璃儀器是漏斗、燒杯、玻璃棒;燒杯用來盛放液體,漏斗用于過濾,玻璃棒用來引流和攪拌,
故答案為:漏斗;玻璃棒;
(5)第③步反應(yīng)是TiOSO4加入水反應(yīng)生成H2TiO3和硫酸的反應(yīng) 的化學(xué)方程式為:TiOSO4+2H2O=H2TiO3+H2SO4,
故答案為:TiOSO4+2H2O=H2TiO3+H2SO4.
點評 本題考查了硫酸法制取二氧化鈦實驗,涉及物質(zhì)提純、分離、制備等流程分析判斷,把握物質(zhì)的性質(zhì)、反應(yīng)原理、實驗技能為解答的關(guān)鍵,題目難度中等.


 應(yīng)用題天天練四川大學(xué)出版社系列答案
應(yīng)用題天天練四川大學(xué)出版社系列答案科目:高中化學(xué) 來源: 題型:選擇題
| A. | 含有3個甲基 | B. | 一氯代物只有一種 | ||
| C. | 使溴水褪色 | D. | 四個碳原子共平面 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題

| A. | 該反應(yīng)的化學(xué)方程式為:X+Y?2Z | |
| B. | 當(dāng)反應(yīng)速率大小關(guān)系為:v(X)=v(Y)=2v(Z)時,該反應(yīng)達到平衡狀態(tài) | |
| C. | 圖a中反應(yīng)達到平衡時,Y的轉(zhuǎn)化率為37.5% | |
| D. | 該反應(yīng)的正反應(yīng)是放熱反應(yīng) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
 高錳酸鉀是一種用途廣泛的強氧化劑,實驗室制備高錳酸鉀所涉及的化學(xué)方程式如下:MnO2熔融氧化:
高錳酸鉀是一種用途廣泛的強氧化劑,實驗室制備高錳酸鉀所涉及的化學(xué)方程式如下:MnO2熔融氧化:查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題

查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題

查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題


查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
 Ⅰ時,反應(yīng)物A的轉(zhuǎn)化率a(A)=60%.x:y=1:2.
Ⅰ時,反應(yīng)物A的轉(zhuǎn)化率a(A)=60%.x:y=1:2.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
 .
.查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com