考點:物質分離和提純的方法和基本操作綜合應用,反應速率的定量表示方法,化學平衡的影響因素,化學平衡的計算,鐵的氧化物和氫氧化物
專題:實驗設計題,化學平衡專題
分析:Ⅰ.(1)鐵物質的量=
=0.02mol,根據化學方程式定量關系計算甲烷消耗的物質的量,依據化學反應速率概念計算得到;
(2)依據化學反應特征和影響平衡因素,結合化學平衡移動原理分析;
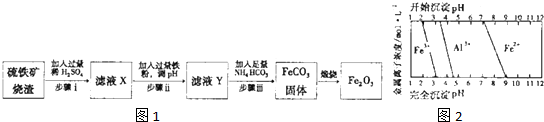
Ⅱ.(3)依據圖象分析可知加入鐵是還原鐵離子,同時調節溶液PH除去鋁離子,亞鐵離子不生成沉淀,溶液PH不高于7;
(4)流程分析,步驟i是硫酸溶解后過濾除去不溶雜質,步驟ii是加入過量鐵調節溶液PH,過濾得到濾液除去過量鐵,步驟iii是過濾得到碳酸亞鐵沉淀;
(5)依據電離平衡常數結合反應平衡常數表達式計算推斷得到;
(6)在空氣中煅燒FeCO
3生成氧化鐵和二氧化碳,依據原子守恒配平書寫化學方程式;
(7)依據氧化鐵不溶于氫氧化鈉溶液,氧化鋁和二氧化硅能溶解于氫氧化鈉溶液設計實驗.
解答:
解:(1)若反應在2L的密閉容器中進行,5min后達到平衡,測得反應生成Fe的質量為1.12g,鐵物質的量=
=0.02mol,結合化學方程式,Fe
2O
3(s)+3CH
4(g)═2Fe(s)+3CO(g)+6H
2(g),計算反應的甲烷物質的量為0.03mol,則該段時間內CH
4的平均反應速率=
=0.003mol/(L?min);
故答案為:0.003mol?L
-1?min
-1;
(2)Fe
2O
3(s)+3CH
4(g)═2Fe(s)+3CO(g)+6H
2(g)△H>0,反應是氣體體積不變的吸熱反應
a.若加入催化劑,V
逆,v
正增大,速率同等程度增大,平衡不發生移動,故a錯誤;
b.反應是吸熱反應,若溫度升高,平衡正向進行,平衡常數K增大,故b錯誤;
c.若增大Fe
2O
3的量,氧化鐵是固體不允許平衡,平衡不移動,故d錯誤;
d.若從反應體系中移走部分CO,減少生成物,平衡正向進行,可提高CH
4的轉化率,故d正確;
故答案為:d;
(3)根據圖象可知,亞鐵離子開始沉淀時的pH值是7,所以要得到碳酸亞鐵,同時調節溶液PH除去鋁離子,亞鐵離子不生成沉淀,則溶液的pH不能高于7,且大于4.7,故答案為:4.7~7;
(4)判斷步驟ⅱ反應主要為Fe
3++2Fe═3Fe
2+,調節溶液pH,得到純凈的Fe
2+,此時鋁離子以Al(OH)
3沉淀形成去除,故答案為:Fe
3++2Fe═3Fe
2+;Al(OH)
3;
(5)反應Fe
2+(aq)+2HCO
3-(aq)═FeCO
3(s)+H
2CO
3(aq)的平衡常數
K=
=
| c(H2CO3)c(CO32-) |
| c(Fe2+)c(CO32-)c2(HCO3-) |
=
=
=4.06×10
6;
故答案為:4.06×10
6;
(6)在空氣中煅燒FeCO
3生成氧化鐵和二氧化碳,依據原子守恒分析,生成氧化鐵同時生成二氧化碳,反應的化學方程式為:4FeCO
3+O
22Fe
2O
3+4CO
2,
故答案為:4FeCO
3+O
22Fe
2O
3+4CO
2;
(7)由于氧化鋁與二氧化硅均能和氫氧化鈉溶液反應,而氧化鐵和氫氧化鈉溶液不反應,因此要提取氧化鐵的實驗方案可以設計為取少量磁鐵礦燒渣,加入足量熱的濃氫氧化鈉溶液中,攪拌,過濾,洗滌烘干得到;
故答案為:取少量磁鐵礦燒渣,加入足量熱的濃氫氧化鈉溶液中,攪拌,過濾,洗滌烘干得到.
點評:本題較為綜合,涉及反應速率計算,化學平衡和反應速率的影響因素,方程式書寫方法,物質分離與提純,實驗方案設計,平衡常數的有關計算,為高頻考點,側重于學生的分析能力和計算能力的考查,注意把握實驗的流程分析.題目難度中等.



 如圖為實驗室某濃硫酸酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃硫酸酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題: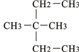 ③CH2=CH-CH3 ④氧氣 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧氣 ⑤氯水 ⑥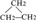 ⑧氯氣 ⑨CH3CH2OH ⑩臭氧?
⑧氯氣 ⑨CH3CH2OH ⑩臭氧?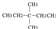 ?CH≡CH?
?CH≡CH?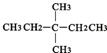 ?H2
?H2