
| 44.12% |
| 12 |
| 8.82% |
| 1 |
| 47.06% |
| 16 |
| 濃硫酸 |
| △ |
| 濃硫酸 |
| △ |
| 27.2g |
| 136g/mol |
| 點燃 |
| 1 |
| 5 |
| 1 |
| 5 |


科目:高中化學 來源: 題型:
| A、1H和3H的質子數相同,它們是同種核素 |
| B、6Li和7Li的質子數相等,電子數也相等 |
| C、14C和14N的質量數相等,它們的中子數相等 |
| D、13C和14C屬于同一種元素,它們的質量數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、BrCl具有和鹵素單質相似的化學性質 |
| B、BrCl和M反應時,BrCl即為氧化劑又為還原劑 |
| C、BrCl和NaOH溶液反應生成NaCI、NaBrO兩種鹽 |
| D、將BrCl跟FeS04溶液反應.溶液會變成無色 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
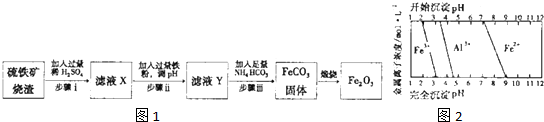
| 微粒平衡 | 平衡常數 | ||||
Fe3CO3(s)?Fe2+(aq)+CO
| Ksp=3.2×10-11 | ||||
H2CO3?H++HCO
| Ka1=4.36×10-7 | ||||
HCO
| Ka2=4.68×10-11 | ||||
2HCO
| K=1.3×-4 |
- 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
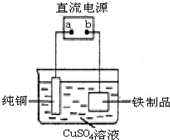 鐵在地殼中的含量約占 5%左右.鐵礦石的種類很多,重要的有磁鐵礦石(主要成分是Fe3O4)、赤鐵礦石(主要成分是 Fe2O3)等.
鐵在地殼中的含量約占 5%左右.鐵礦石的種類很多,重要的有磁鐵礦石(主要成分是Fe3O4)、赤鐵礦石(主要成分是 Fe2O3)等.查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com