
| A. | 消耗NaOH溶液的體積為0.5L | |
| B. | 產生氣體的體積一定是4.48L | |
| C. | Cu、Cu2O與硝酸反應后剩余為0.5mol | |
| D. | Cu、Cu2O的物質的量之比是1:2 |
分析 在所得溶液中加入NaOH溶液后,此時溶液呈中性,金屬離子已完全沉淀,溶液中溶質為NaNO3,沉淀為Cu(OH)2,質量為39.2g,物質的量為$\frac{39.2g}{98g/mol}$=0.4mol,根據銅原子守恒,反應后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,根據銅元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],設Cu和Cu2O的物質的量分別為xmol、ymol,根據二者質量有 64x+144y=27.2,根據銅元素守恒有x+2y=0.4,聯立方程解得x=0.2,y=0.1.
A.利用電子轉移守恒計算n(NO),根據N元素守恒可知:n原(HNO3)=n(NO)+n(NaNO3),根據Na元素可知n(NaNO3)=n(NaOH),再根據V=$\frac{n}{c}$計算需要NaOH溶液體積;
B.NO不一定處于標況下;
C.根據N元素守恒,可知n剩余(HNO3)+2n[[Cu(NO3)2]=n(NaNO3);
D.根據分析可知Cu、Cu2O的物質的量之比.
解答 解:在所得溶液中加入NaOH溶液后,此時溶液呈中性,金屬離子已完全沉淀,溶液中溶質為NaNO3,沉淀為Cu(OH)2,質量為39.2g,物質的量為$\frac{39.2g}{98g/mol}$=0.4mol,根據銅原子守恒,反應后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,根據銅元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],設Cu和Cu2O的物質的量分別為xmol、ymol,根據二者質量有 64x+144y=27.2,根據銅元素守恒有x+2y=0.4,聯立方程解得x=0.2,y=0.1.
A.根據電子轉移守恒可知:3n(NO)=2n(Cu)+2n(Cu2O),所以3n(NO)=2×0.2mol+2×0.1mol,解得n(NO)=0.2mol,根據N元素守恒可知n原(HNO3)=n(NO)+n(NaNO3)=0.2mol+n(NaNO3)=2mol/L×0.6L=1.2mol,所以n(NaNO3)=1mol,根據Na元素可知n(NaOH)=n(NaNO3)=1mol,需要NaOH溶液體積為$\frac{1mol}{2mol/L}$=0.5L,故A正確;
B.生成的NO為0.2mol,但不一定是標況下,其體積不一定為4.48L,故B錯誤;
C.反應后的溶液中加入氫氧化鈉溶液,氫氧化鈉與硝酸銅反應,剩余的氫氧化鈉與硝酸反應,最后為硝酸鈉溶液,根據氮元素守恒可知反應后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),所以n(HNO3)=n(NaNO3)-2n[[Cu(NO3)2]=1mol-2×0.4mol=0.2mol,故C錯誤;
D.由上述分析可知,n(Cu):n(Cu2O)=0.2mol:0.1mol=2:1,故D錯誤,
故選:A.
點評 本題考查混合物計算、氧化還原反應的計算,需要學生清楚反應過程,充分利用守恒思想進行解答,較好的考查學生分析計算能力,B選項為易錯點,學生容易忽略NO不一定是標況下.


科目:高中化學 來源: 題型:選擇題
| A. | 金屬焊接時可用NH4Cl溶液作除銹劑 | |
| B. | 配制FeSO4溶液時,加入一定量Fe粉 | |
| C. | 長期施用銨態氮肥會使土壤酸化 | |
| D. | 向FeCl3溶液中加入CaCO3粉末后有氣泡產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Z>Y>X | |
| B. | X與R的核電荷數相差18 | |
| C. | 氣態氫化物穩定性:W>R | |
| D. | Y與Z兩者最高價氧化物對應的水化物能相互反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
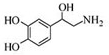
| A. | 每個去甲腎上腺素分子中含有3個酚羥基 | |
| B. | 每個去甲腎上腺素分子中含有1個手性碳原子 | |
| C. | 1mol去甲腎上腺素最多與2mol Br2發生取代反應 | |
| D. | 去甲腎上腺素既能與碳酸氫鈉反應生成二氧化碳氣體,又能與鹽酸反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用稀HNO3溶解FeS固體:FeS+2H+═Fe2++H2S↑ | |
| B. | 純堿溶液呈堿性的原因:CO32-+2H2O?H2CO3+2OH- | |
| C. | NaHSO4溶液與Ba(OH)2溶液混合呈中性:2HSO4-+Ba2++2OH-═BaSO4↓+SO42-+2H2O | |
| D. | 氫氧化銅溶于氫溴酸:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
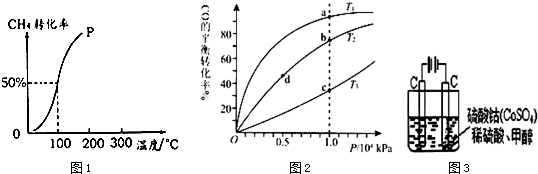
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com