
分析 (1)先將物質的按照堿、鹽、酸的順序分類,再根據鹽的水解和弱電解質的電離特點比較pH;
(2)pH=3的醋酸,其濃度大于0.001mol/L,pH=11的氫氧化鈉,其濃度等于0.001mol/L,等體積混合后,醋酸過量;0.1mol•l-1的醋酸和0.1mol•l-1的氫氧化鈉溶液等體積混合后,兩者恰好完全反應;根據“三個守恒”來分析;
(3)根據物料守恒來分析;若醋酸和氫氧化鈉溶液恰好完全反應,則溶液顯堿性;根據“三個守恒”來分析;
解答 解:(1)鹽酸和醋酸為酸,氫氧化鋇為堿,碳酸鈉、氯化鉀和氯化銨為鹽,碳酸鈉為強堿弱酸鹽,其溶液呈堿性,氯化鉀為強酸強堿鹽,為中性,氯化銨為強酸弱堿鹽,其溶液為酸性,相同濃度的鹽酸和醋酸,醋酸中氫離子濃度小于鹽酸,所以pH鹽酸小于醋酸,則這幾種溶液的pH由小到大的順序是①②⑥⑤④③.
故答案為:①②⑥⑤④③.
(2)pH=3的醋酸,其濃度大于0.001mol/L,pH=11的氫氧化鈉,其濃度等于0.001mol/L,等體積混合后,醋酸過量,為醋酸和醋酸鈉的混合溶液,則溶液顯酸性;0.1mol•l-1的醋酸和0.1mol•l-1的氫氧化鈉溶液等體積混合后,兩者恰好完全反應,得醋酸鈉溶液,水解顯堿性;
溶液中存在物料守恒、電荷守恒和質子守恒,根據電荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故答案為:酸性;堿性;c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
(3)將m mol/L的醋酸和n mol/L的氫氧化鈉溶液等體積混合后,溶液體積加倍,無論醋酸的反應情況如何,根據物料守恒可知:c(CH3COO-)+c(CH3COOH)=$\frac{m}{2}$mol/L;若醋酸和氫氧化鈉溶液恰好完全反應,則溶液顯堿性,故要使pH=7顯中性,必須醋酸稍過量,即m>n;溶液中存在物料守恒、電荷守恒和質子守恒,根據電荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故答案為:$\frac{m}{2}$;>;c(Na+)+c(H+)=c(CH3COO-)+c(OH-).
點評 本題依托弱電解質的電離和鹽的水解,考查了pH大小的判斷知識點,明確物質的性質及弱電解質電離特點是解本題關鍵.


 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:解答題
| 難溶電解質 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全時的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 重金屬鹽能使蛋白質變性,所以誤食重金屬鹽會中毒 | |
| B. | 蛋白質溶液中加入飽和(NH4)2SO4溶液,蛋白質析出,再加水也不溶解 | |
| C. | 濃HNO3濺在皮膚上,使皮膚呈黃色,是由于濃HNO3和蛋白質發生顏色反應 | |
| D. | 人工合成的具有生命活性的蛋白質-結晶牛胰島素,是1965年我國科學家最先合成的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 下列各組物質中,物質之間通過一步反應就能實現如圖所示轉化的是( )
下列各組物質中,物質之間通過一步反應就能實現如圖所示轉化的是( )| a | b | c | |
| A | N2 | NO | NO2 |
| B | S | SO2 | SO3 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉著火時,用細沙覆蓋滅火 | |
| B. | 金屬鈉與氧氣反應,條件不同,產物不同 | |
| C. | Na的化學性質比鎂活潑,故用Na與MgCl2溶液反應制取金屬鎂 | |
| D. | 9.2g金屬鈉與足量水反應,反應過程中有0.4mol電子轉移 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
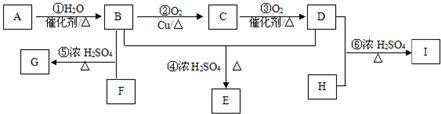
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
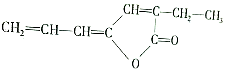 ,該物質在現代工業合成中大有用途,請回答下列有關該物質的問題:
,該物質在現代工業合成中大有用途,請回答下列有關該物質的問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com