
 甲醇是重要的燃料,有廣闊的應用前景:工業上一般以CO和為原料合成甲醇,該反應的熱化學方程式為:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有廣闊的應用前景:工業上一般以CO和為原料合成甲醇,該反應的熱化學方程式為:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1分析 (1)根據平衡移動原理進行判斷,溫度升高,反應速率加快,使用催化劑,反應速率加快;
(2)根據蓋斯定律和題中熱化學方程式,根據反應
①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1 ,
根據蓋斯定律:①-②-③×2得寫出甲醇完全燃燒生成二氧化碳的熱化學方程式;
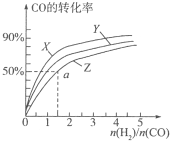
(3)①合成甲醇的反應是放熱反應,溫度升高,轉化率降低,依據圖象變化分析判斷;
②a點時,CO轉化率50%,反應消耗了2mol×50%=1molCO,消耗氫氣2mol,圖象中可知,起始量氫氣物質的量n(H2)=1.5n(CO)=3mol,剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,結合化學平衡三段式列式計算平衡濃度,根據平衡常數表達式和一氧化碳的轉化率求算,K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
(4)①恒溫下,分別將1molCO和2molH2置于恒容容器I和恒壓容器Ⅱ中,反應前后氣體體積減小,恒壓容器中體積減小是相當于恒容容器達到平衡狀態下,增大壓強對平衡的影響,壓強增大,反應速率增大,達到平衡需要的時間短,恒壓容器中甲醇含量增大;
②平衡時,測得容器Ⅰ中的壓強減小了30%,氣體物質的量減小30%,結合化學平衡三段式列式計算;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
變化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
3-2x=3-3×30%
x=0.45mol
轉化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)有利于增大該反應的反應速率且利于反應正向進行結合化學平衡移動原理分析.
A、隨時將CH3OH與反應混合物分離,減小生成物的濃度,利于反應正向進行,但反應速率減小,故A錯誤;
B、反應是放熱反應,溫度降低,利于反應正向進行,但反應速率變小,故B錯誤;
C、反應前后氣體體積減小,壓強增大,利于反應正向進行,反應速率加快,故C正確;
D、使用催化劑,反應速率加快,不改變化學平衡,不能利于反應正向進行,故D錯誤;
故選C;
(2)根據反應①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1 ,
根據蓋斯定律:①-②-③×2得:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
(3)①根據反應CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,是放熱反應,溫度越高,轉化率越低,所以曲線Z對應的溫度最高,X對應的一氧化碳轉化率最大,溫度最低,Y介于二者之間,在圖中三條曲線,對應的溫度由高到低的順序是Z>Y>X;
故答案是:Z>Y>X;
②a點時,CO轉化率50%,反應消耗了2mol×50%=1molCO,消耗氫氣2mol,圖象中可知,起始量氫氣物質的量n(H2)=1.5n(CO)=3mol,剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 2 3 0
變化量(mol) 1 2 1
平衡量(mol) 1 1 1
a點各組分的濃度是:c(CH3OH)=$\frac{1mol}{2L}$=0.5mol/L,c(CO)=$\frac{1mol}{2L}$=0.5mol/L,c(H2)=$\frac{1mol}{2L}$=0.5mol/L,
帶入表達式得:K=$\frac{0.5mol/L}{0.5mol/L×(0.5mol/L)^{2}}$=4L2•mol-2,
曲線Z在對應溫度下CH3OH(g)?CO(g)+2H2(g)的平衡常數為上述平衡常數的倒數=0.25;
故答案是:0.25;
(4)①恒溫下,分別將1molCO和2molH2置于恒容容器I和恒壓容器Ⅱ中,發生反應CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1 ;反應前后氣體體積減小,恒壓容器中體積減小是相當于恒容容器達到平衡狀態下,增大壓強對平衡的影響,壓強增大,反應速率增大,達到平衡需要的時間短,ⅠⅡ達到平衡所需時間Ⅰ>Ⅱ,達到平衡后,恒壓容器中平衡正向進行,所以兩容器中CH3OH的體積分數Ⅰ<Ⅱ;
故答案為:>,<;
②平衡時,測得容器Ⅰ中的壓強減小了30%,氣體物質的量減小30%
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
變化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
測得容器Ⅰ中的壓強減小了30%,氣體物質的量減小30%
3-2x=3-3×30%
x=0.45mol
則該容器中CO的轉化率=$\frac{0.45mol}{1mol}$×100%=45%;
故答案為:45%.
點評 本題考查了影響反應速率的因素及反應平衡常數的計算、熱化學方程式的書寫等知識,注意蓋斯定律的應用,本題難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 發展核電、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效減少環境污染 | |
| B. | 物質變化中炭化、鈍化、皂化、酯化、熔化都屬于化學變化 | |
| C. | 氫鍵、分子間作用力、離子鍵和共價鍵均為微粒間的相互作用力 | |
| D. | 農業廢棄物、城市工業有機廢棄物及動物糞便中都蘊藏著豐富的生物質能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反應前2min的平均速率ν(Z)=2.0×10-5 mol/(L•min) | |
| B. | 4min時,ν(逆)>ν(正) | |
| C. | 該溫度下,此反應的平衡常數K=1.44 | |
| D. | 7min時,反應還未達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/LCH3COONa溶液與0.1mol/L HCl溶液等體積混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液與0.1mol/L氨水等體積混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3與0.1mol/LNaHCO3溶液等體積混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液與0.1mol/LNaOH溶液等體積混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 光化學煙霧是氮氧化物受紫外線照射后與空氣中的一些碳氫化合物作用后生成的一種有毒煙霧 | |
| B. | 以糧食為原料釀酒過程的變化包括糧食→淀粉→葡萄糖→乙醇 | |
| C. | 航天飛機上使用的隔熱陶瓷瓦,大多是以碳纖維做增強體的新型復合材料 | |
| D. | 綠色化學的核心是應用化學原理對環境污染進行治理 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
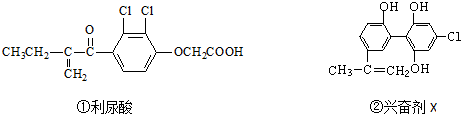
| A. | 利尿酸分子中有三種含氧官能團,在核磁共振氫譜上共有六個峰 | |
| B. | 1 mol興奮劑X與足量濃溴水反應,最多消耗4 mol Br2 | |
| C. | 兩種興奮劑最多都能和含3molNaOH的溶液反應 | |
| D. | 兩種分子中的所有碳原子均不可能共平面 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com