
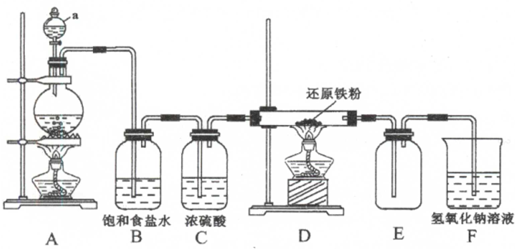
分析 根據題中提供的裝置可知,該實驗是用濃鹽酸和二氧化錳加熱制取氯氣,濃鹽酸具有揮發性,所以制取的氯氣中含有HCl,用飽和食鹽水除去氯化氫,用濃硫酸干燥氯氣,然后將純凈、干燥的氯氣和Fe加熱制取FeCl3,氯氣有毒不能直接排空,且氯氣能和堿溶液反應,所以用NaOH溶液處理尾氣,氯化鐵易水解,為防止氫氧化鈉溶液中的水份揮發到生成氯化鐵的裝置中,在產生氯化鐵和尾氣吸收裝置之間要加干燥裝置,氯化鐵在100℃左右升華,生成的氯化鐵在導管中容易冷卻成固體,會堵塞導管,據此答題.
解答 解:根據題中提供的裝置可知,該實驗是用濃鹽酸和二氧化錳加熱制取氯氣,濃鹽酸具有揮發性,所以制取的氯氣中含有HCl,用飽和食鹽水除去氯化氫,用濃硫酸干燥氯氣,然后將純凈、干燥的氯氣和Fe加熱制取FeCl3,氯氣有毒不能直接排空,且氯氣能和堿溶液反應,所以用NaOH溶液處理尾氣,氯化鐵易水解,為防止氫氧化鈉溶液中的水份揮發到生成氯化鐵的裝置中,在產生氯化鐵和尾氣吸收裝置之間要加干燥裝置,氯化鐵在100℃左右升華,生成的氯化鐵在導管中容易冷卻成固體,會堵塞導管,
(1)根據裝置圖可知,儀器a的名稱是分液漏斗,F裝置的作用是吸收未反應的氯氣,防止污染環境,
故答案為:分液漏斗;吸收未反應的氯氣,防止污染環境;
(2)D中發生反應為鐵與氯氣反應生成氯化鐵,反應的化學方程式為2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3,A中發生的反應是濃鹽酸與二氧化錳生成氯氣的反應,反應的離子方程式為MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案為:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)根據上面的分析可知,上述實驗裝置的設計還有不完善的地方,主要有導管易被產品堵塞,不安全;產品易受潮而水解,導致產品不純,
故答案為:導管易被產品堵塞,不安全;產品易受潮而水解,導致產品不純.
點評 本題考查氯氣實驗室制法、氯化鐵的制備等知識點,側重考查實驗操作及鹽類水解等知識,為高頻考點,知道每個裝置的作用及可能發生的反應,難點是實驗裝置先后順序排列,題目難度不大.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
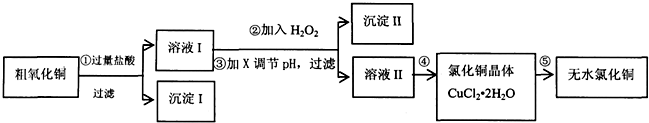
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題




查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 先通二氧化碳、后通氨氣、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循環使用 | D. | 往甲中通CO2有利于制備(NH4)2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com