

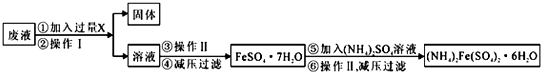
分析 由制備流程可知,碘與NaOH溶液反應生成NaI、NaIO3,加入Fe與NaIO3發生氧化還原反應生成NaI、氫氧化亞鐵,經過濾后得到固體氫氧化亞鐵,過濾后溶液中主要含NaI,濃縮、冷卻、結晶、分離、干燥、提純得到NaI.
(1)碘與強堿反應,發生歧化反應,碘元素化合價0價變化為+5價和-1價,結合電子守恒分析配平,反應③是氫氧化亞鐵灼燒生成氧化鐵和水,結合原子守恒配平化學方程式;
(2)欲制得較純凈的NaI,在濃縮、冷卻時最好采取的措施是低壓蒸發濃縮,并充入氮氣隔絕空氣;
(3)依據碘單質遇到淀粉變藍色設計實驗驗證;
(4)2Na2S2O3+I2=Na2S4O6+2NaI,結合反應定量關系計算生成的碘單質的量,樣品質量減去碘單質的質量剩余為KI的質量,據此計算純度.
解答 解:(1)碘與強堿反應,發生歧化反應,碘元素化合價0價變化為+5價和-1價,結合電子守恒分析配平得到離子方程式為:3I2+6OH-=IO3-+5I-+3H2O,反應③是氫Fe(OH)2不穩定,可與空氣中氧氣反應而被氧化而生成Fe(OH)3,在灼燒時生成Fe2O3,則反應的總方程式為4Fe(OH)2+O2$\frac{\underline{\;高溫\;}}{\;}$2 Fe2O3+4H2O,
故答案為:5 I-;4Fe(OH)2+O2$\frac{\underline{\;高溫\;}}{\;}$2 Fe2O3+4H2O;
(2)純凈的NaI為白色晶體,在空氣和水溶液中因逐漸析出碘而變黃或棕.欲制得較純凈的NaI,在濃縮、冷卻時最好采取的措施是低壓蒸發濃縮,并充入氮氣隔絕空氣,防止碘離子被氧化,故選C,
故答案為:C;
(3)淀粉遇碘變藍,反檢驗產品中是否含有游離的碘(I2)的具體操作為:取少量反應后的溶液于試管中,滴入幾滴淀粉溶液,若溶液未變藍,則證明碘已反應完全;反之,碘未反應完全,(或取少量反應后的溶液于試管中,滴入幾滴CCl4,振蕩、靜置,若下層液體呈無色,證明碘已反應完全;若下層液體呈紫紅色,證明碘未反應完全),
故答案為:于試管中并滴入幾滴淀粉溶液,若溶液未變藍色,證明碘已完全轉化,產品中沒有游離碘;如果溶液變藍,則說明碘沒有轉化完全,產品中含有游離碘;
(4)稱取m g成品,溶解并滴加幾滴淀粉溶液,再用a mol•L-1的硫代硫酸鈉(Na2S2O3)標準溶液進行滴定至溶液由藍色變為無色,消耗硫代硫酸鈉VmL,
結合反應定量關系計算生成的碘單質的量,樣品質量減去碘單質的質量剩余為KI的質量
2Na2S2O3+I2=Na2S4O6+2NaI,
2 1
a mol•L-1×V×10-3L n
n=$\frac{aV}{2}$×10-3mol
據此NaI純度的計算式為:$\frac{{m-127aV×{{10}^{-3}}}}{m}×100%$
故答案為:$\frac{{m-127aV×{{10}^{-3}}}}{m}×100%$.
點評 本題考查物質制備實驗,注意把握制備流程中發生的反應及操作,題目涉及氧化還原反應及碘的特性,注重基礎知識的考查,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Ba(OH)2•8H2O與NH4C1反應 | B. | 水解反應 | ||
| C. | 醋酸的電離 | D. | 鹽酸與NaOH溶液的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
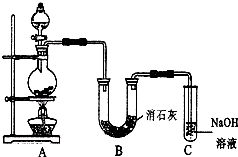 某學生設計如圖所示的實驗裝置,利用氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應).
某學生設計如圖所示的實驗裝置,利用氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
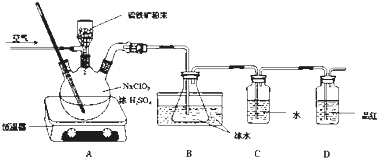
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
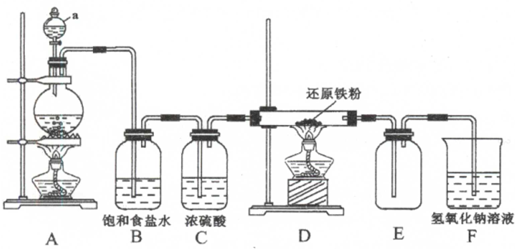
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 熔點/℃ | 沸點/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗序號 | 起始溫度t1/℃ | 終止溫度(t2)℃ | 溫差(t2-t1)℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com