
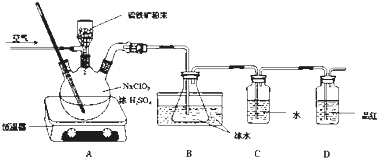
分析 (1)NaClO3與FeS2的反應中,氯從+5價變為+4價,鐵從+2價變為+3價,硫從-2價變為+6價,根據化合價升降法結合電荷守恒和元素守恒配平離子方程式;
(2)ClO2有強氧化性,能使品紅褪色,通過品紅可以判斷ClO2是否吸收完全;
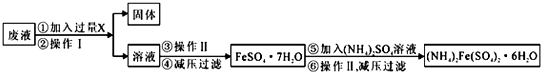
(3)上述反應完后的廢液主要含有Fe3+,還有Al3+、Mg2+、H+、Cl-等,在廢液中加入過量的鐵粉,將鐵離子還原為亞鐵離子,過濾得濾液,將濾液蒸發濃縮、冷卻結晶,再減壓過濾可得硫酸亞鐵晶體,在硫酸亞鐵晶體加入硫酸銨溶液,再蒸發濃縮、冷卻結晶,再減壓過濾可得(NH4)2Fe(SO4)2•6H2O晶體,根據電子復件守恒可得關系式5Fe2+~MnO4-,根據KMnO4的物質的量可計算出樣品中鐵元素的質量,進而計算鐵元素的質量分數,據此答題.
解答 解:(1)NaClO3與FeS2的反應中,氯從+5價變為+4價,鐵從+2價變為+3價,硫從-2價變為+6價,根據化合價升降法結合電荷守恒和元素守恒配平離子方程式為15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O,
故答案為:15;1;14;15;1;2;7;
(2)ClO2有強氧化性,能使品紅褪色,所以裝置D的作用是檢驗ClO2是否吸收完全,
故答案為:檢驗ClO2是否吸收完全;
(3)上述反應完后的廢液主要含有Fe3+,還有Al3+、Mg2+、H+、Cl-等,在廢液中加入過量的鐵粉,將鐵離子還原為亞鐵離子,過濾得濾液,將濾液蒸發濃縮、冷卻結晶,再減壓過濾可得硫酸亞鐵晶體,在硫酸亞鐵晶體加入硫酸銨溶液,再蒸發濃縮、冷卻結晶,再減壓過濾可得(NH4)2Fe(SO4)2•6H2O晶體,根據電子復件守恒可得關系式5Fe2+~MnO4-,根據KMnO4的物質的量可計算出樣品中鐵元素的質量,進而計算鐵元素的質量分數,據此答題;
①根據上面的分析可知,操作Ⅰ的名稱為過濾,
故答案為:過濾;
②根據上面的分析可知,試劑X是 Fe,發生的主要反應的離子方程式為2Fe3++Fe=3Fe2+,
故答案為:Fe;2Fe3++Fe=3Fe2+;
③根據電子復件守恒可得關系式5Fe2+~MnO4-,反應中消耗的KMnO4的物質的量為0.01000mol/L×21.00×10-3 L=2.1×10-4mol,所以樣品中鐵元素的質量為2.1×10-4mol×5×$\frac{250}{25}$×56g/mol=0.588g,故鐵元素的質量分數為$\frac{0.588g}{5.000g}$×100%=11.76%,
故答案為:11.76%.
點評 本題考查了物質制備的實驗、實驗步驟、實驗基本操作及化學計算等,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
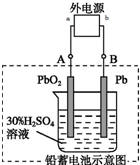 鉛蓄電池是典型的可充電電池,電池的兩極材料分別是Pb、PbO2,電解質H2SO4.請回答下列問題.
鉛蓄電池是典型的可充電電池,電池的兩極材料分別是Pb、PbO2,電解質H2SO4.請回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 斷裂3NA個碳碳雙鍵時,放出3260kJ的熱量 | |
| B. | 消耗336L O2時,放出6520kJ的熱量 | |
| C. | 轉移30NA個電子時,放出3260kJ的熱量 | |
| D. | 生成3NA個氣態水分子時,放出3260kJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
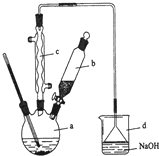 溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:
溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸點/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{鐵粉}{→}$
+Br2$\stackrel{鐵粉}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化學 來源: 題型:填空題




查看答案和解析>>
科目:高中化學 來源: 題型:解答題



查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鍺可用于制造半導體材料 | |
| B. | RbOH的堿性強于Ca(OH)2 | |
| C. | SrCO3是白色難溶于水易溶于鹽酸的化合物 | |
| D. | 砹化銀(AgAt)是白色難容于稀硝酸的化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com