

分析 (1)由銅電極的質量增加,則Cu電極為陰極,可知X為電源的負極;
(2)A中電解氯化鉀,生成NaOH,B中電解硫酸銅溶液生成硫酸,根據C中電極反應判斷;
(3)B中陽極反應為4OH--4e-═2H2O+O2↑,根據電極反應及電子守恒來計算;
(4)A中發生2KCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2KOH+H2↑+Cl2↑,根據A中的電極反應及與C中轉移的電子守恒來計算.
解答 解:(1)由銅電極的質量增加,發生Ag++e-═Ag,則Cu電極為陰極,Ag為陽極,Y為正極,可知X為電源的負極,故答案為:負極;
(2)A中電解氯化鉀,生成KOH,所以pH增大,B中電解硫酸銅溶液生成硫酸,溶液中氫離子濃度增大,pH減小,C中陰極反應為Ag++e-═Ag,陽極反應為Ag-e-═Ag+,溶液濃度不變,則pH不變,
故答案為:增大;減小;不變;
(3)C中陰極反應為Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,則轉移的電子為0.02mol,
B中陽極反應為4OH--4e-═2H2O+O2↑,則轉移0.02mol電子生成氧氣為0.005mol,其體積為0.005mol×22.4L/mol=0.112L=112mL,
則在陰極也生成112mL氣體,由2H++2e-═H2↑,則氫氣的物質的量為0.005mol,該反應轉移的電子為0.01mol,
則Cu2++2e-═Cu中轉移0.01mol電子,所以Cu2+的物質的量為0.005mol,通電前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案為:4OH--4e-=O2↑+2H2O;0.025;
(4)由A中發生2KCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,離子方程式為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑,
由電子守恒可知,轉移0.02mol電子時生成0.02molKOH,忽略溶液體積的變化,
則c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,溶液pH=13,
故答案為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑;13.
點評 本題考查電解原理,明確Cu電極的質量增加是解答本題的突破口,并明確發生的電極反應及電子守恒即可解答,注意計算時電子守恒的應用,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

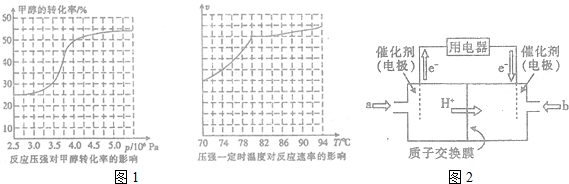
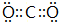 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | BrCl的化學性質和Cl2相似,Cl2與水反應是氧化還原反應,BrCl+H2O=HCl+HBrO也是氧化還原反應 | |
| B. | 弱堿性條件下,甲酸乙酯能與氫氧化銅反應,乙酸乙酯也能與氫氧化銅反應 | |
| C. | 苯不能使酸性高錳酸鉀褪色,甲苯也不能使酸性高錳酸鉀褪色 | |
| D. | CO2與SiO2均為酸性氧化物,CO2能與NaOH溶液反應,SiO2也能與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
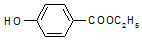 ,生產過程如圖:
,生產過程如圖: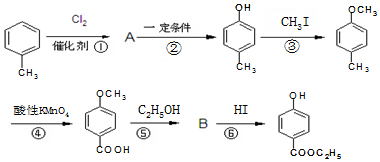
 .
. ,-X、-Y為取代基)是對羥基苯甲酸乙酯的同分異構體且能發生銀鏡反應,則-X的結構簡式可能是-OH、-CH2OH 或-OCH3.
,-X、-Y為取代基)是對羥基苯甲酸乙酯的同分異構體且能發生銀鏡反應,則-X的結構簡式可能是-OH、-CH2OH 或-OCH3.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放熱反應中,反應物的總能量大于生成物的總能量 | |
| B. | 斷開化學鍵的過程會放出能量 | |
| C. | 加熱才能發生的反應一定是吸熱反應 | |
| D. | 酸堿中和反應都是吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O、Na2O2、Al2O3、CuO都是堿性氧化物 | |
| B. | 純堿、燒堿均屬堿類 | |
| C. | NaOH、KOH、Ba(OH)2、Ca(OH)2都是強堿 | |
| D. | HCl、CH3COOH、HNO3都是強酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com