
分析 (1)(Ⅰ)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(Ⅱ)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ•mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)可書寫熱化學方程式;
(2)根據平衡體系中各組分的體積分數均為$\frac{1}{4}$,利用三段式計算出平衡時各組分的含量,計算平衡常數;
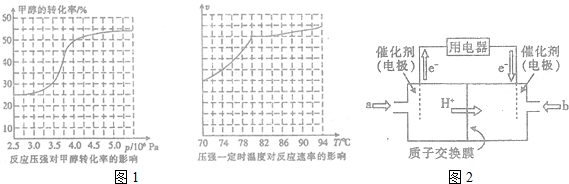
(3)①依據轉化率曲線分析判斷;
②圖象分析速率隨溫度變化的趨勢分析回答;
(4)①根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應;
②根據電解池的工作原理和電極方程式來計算.
解答 解:(1)根據(Ⅰ)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(Ⅱ)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ•mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制備甲醇蒸氣的熱化學方程式為2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1,
故答案為:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1;
(2)CH4(g)+CO2(g)?2CO(g)+2H2(g)
起始(mol) 6 6 0 0
變化(mol) x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
平衡體系中各組分的體積分數均為$\frac{1}{4}$,所以6-x=2x,解得x=2,
則此溫度下該反應的平衡常數X=$\frac{c{\;}^{2}(CO)•c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{4})•c(CO{\;}_{2})}$=$\frac{1{\;}^{2}×1{\;}^{2}}{1×1}$=1,
故答案為:1;
(3)①從反應壓強對甲醇轉化率的影響“效率“看,圖象中轉化率變化最大的是4.0×106Pa,故答案為:4.0×106Pa;
②依據圖象分析溫度在高于80°C對反應速率影響不大,反應是放熱反應,溫度過高,平衡逆向進行,不利于轉化率增大,
故答案為:高于80℃時,溫度對反應速率影響較小,且反應放熱,升高溫度時平衡逆向移動,轉化率降低;
(4)①根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應,負極反應式為 CH3OH-6e-+H2O=CO2+6H+,正極上氧氣得電子發生還原反應,電極反應式為O2+4e-+4H+=2H2O,
故答案為:負;
②用此電池以惰性電極電解飽和食鹽水的電極反應為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$H2↑+Cl2↑+2OH-,當兩極共收集到標準狀況下的氣體1.12L(0.05mol)時,則生成氫氧化鈉的物質的量是0.05mol,所以COH-=$\frac{0.05mol}{0.5L}$=0.1mol/L,所以PH=13,故答案為:13.
點評 本題考查較為綜合,涉及了蓋斯定律的應用、熱化學方程式的計算書寫、化學平衡的計算、圖象分析判斷以及電化學的知識等,注意把握蓋斯定律的運用,掌握原電池的工作原理,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 不是在室溫下 | B. | 弱酸溶液與強堿溶液反應 | ||
| C. | 強酸溶液與強堿溶液反應 | D. | 二元強酸溶液和一元強堿溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,32 g O3含有的氧原子數目為2NA | |
| B. | 5.6 g的Fe在足量Cl2中完全燃燒轉移電子數為0.2NA | |
| C. | 0.1 mol•L-1 Na2SO4溶液含有的鈉離子數目為0.2NA | |
| D. | 標準狀況下,22.4 L苯含有的碳原子數目為6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如表:
在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如表:| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 弱酸 | HNO2 | HClO | H2CO3 | H2SO3 |
| 電離平衡常數 (25℃) | Ki=5.1×10-4 | Ki=2.98×10-8 | $\begin{array}{l}{K_{i1}}=4.3×{10^{-7}}\\{K_{i2}}=5.6×{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54×{10^{-2}}\\{K_{i2}}=1.02×{10^{-7}}\end{array}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 甲 | 乙 | 丙 | |
| 容積 | 1L | 1L | 0.5L |
| 起始加入物質 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡時 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃時該反應的平衡常數K為3.75 | |
| B. | 平衡時,X轉化率:甲<丙 | |
| C. | 若乙是絕熱容器,則平衡時,c(Z)>1.2mol•L-1 | |
| D. | 前2min內,丙容器中用X表示的平均反應速率v(X)=0.6mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com