
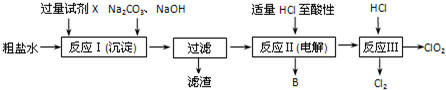
分析 (1)粗食鹽水中含有Ca2+、Mg2+、SO42-等雜質,除雜操作時,往粗鹽水中先加入過量的試劑BaCl2,用于除去SO42-,至沉淀不再產生后,再加入過量的Na2CO3來除去原溶液中的Ca2+和為除去SO42-而引入的Ba2+,然后再加入NaOH溶液來除去Mg2+,充分反應后將沉淀一并濾去;經檢測發現濾液中仍含有一定量的SO42-,是因為在溶液中沉淀溶解平衡,BaSO4 和BaCO3的Ksp相差不大,當溶液中存在大量的CO32-離子時,BaSO4(s)會部分轉化為BaCO3(s),
(2)將食鹽水在特定條件下電解得到的氯酸鈉,根據氧化還原反應中的化合價升高與降低的總數相等判斷電解時生成的氣體B的名稱;根據題意反應Ⅲ為氯酸鈉與氯化氫反應生成二氧化氯、氯化鈉和水;
(3)①ClO2溶液顯酸性,應該用酸式滴定管準確量取10.00 mL ClO2溶液;
②為了減少實驗的偶然性,減少實驗誤差,實驗至少須平行測定兩次,取其平均值;
③由方程式ClO2+I-+H+-I2+Cl-+H2O、I2+2S2O32-═2I-+S4O62-得關系式ClO2~5S2O32-,n(S2O32-)=cV2×10-3mol,所以V1mL ClO2的溶液中含有的ClO2的物質的量為2cV2×10-4mol,根據c=$\frac{n}{V}$計算出原ClO2溶液的物質的量濃度.
解答 解:(1)除雜操作時,往粗鹽水中先加入過量的試劑BaCl2,用于除去SO42-,至沉淀不再產生后,再加入過量的Na2CO3來除去原溶液中的Ca2+和為除去SO42-而引入的Ba2+;然后再加入NaOH溶液來除去Mg2+,充分反應后將沉淀一并濾去;經檢測發現濾液中仍含有一定量的SO42-,是因為在溶液中沉淀溶解平衡,BaSO4 和BaCO3的Ksp相差不大,當溶液中存在大量的CO32-離子時,BaSO4(s)會部分轉化為BaCO3(s),
故答案為:BaCl2;BaSO4和BaCO3的Ksp相差不大,當溶液中存在大量的CO32-離子時,BaSO4(s)會部分轉化為BaCO3(s);
(2)將食鹽水在特定條件下電解得到的氯酸鈉,根據氧化還原反應中的化合價升高與降低的總數相等可知電解時生成的氣體B為H2;根據題意反應Ⅲ為氯酸鈉與氯化氫反應生成二氧化氯、氯化鈉和水,反應的化學方程式為:2NaClO3+4HCl═2ClO2↑+2NaCl+2H2O,
故答案為:H2;2NaClO3+4HCl═2ClO2↑+2NaCl+2H2O;
(3)①ClO2溶液顯酸性,所以準確量取10.00 mL ClO2溶液的玻璃儀器是酸式滴定管,
故答案為:酸式滴定管;
②在堿性滴定實驗過程中難免會產生誤差,為了減少實驗的偶然性,減少實驗誤差,實驗至少須平行測定兩次,取其平均值,這樣就更接近理論值,
故答案為:減少實驗誤差;
③由方程式ClO2+I-+H+-I2+Cl-+H2O、I2+2S2O32-═2I-+S4O62-得關系式ClO2~5S2O32-,n(S2O32-)=cV2×10-3mol,所以V1mL ClO2的溶液中含有的ClO2的物質的量為2cV2×10-4mol,則10mL的原溶液含有ClO2的物質的量為:2cV2×10-4mol×$\frac{100mL}{{V}_{1}}$=$\frac{2c{V}_{2}}{{V}_{1}}$×10-2mol,所以原ClO2溶液的物質的量濃度為:$\frac{\frac{2c{V}_{2}}{{V}_{1}}×1{0}^{-2}mol}{0.01L}$=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L,
故答案為:$\frac{2c{V}_{2}}{{V}_{1}}$.
點評 本題考查了性質實驗方案的設計、化學實驗基本操作方法及其綜合應用,題目難度中等,明確實驗原理及化學實驗基本操作方法為解答關鍵,試題綜合性較強,充分考查了學生的分析、理解能力及靈活應用基礎知識的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤⑧⑨ | B. | ②④⑤⑦⑨ | C. | ①③⑥⑧⑨ | D. | ③⑤⑥⑦⑨ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3N4晶體是原子晶體 | |
| B. | C3N4晶體中,C-N鍵的鍵長比金剛石中的C-C鍵的鍵長要短 | |
| C. | C3N4晶體中每個C原子連接4個N原子,而每個N原子連接3個C原子 | |
| D. | C3N4晶體中微粒間通過離子鍵結合 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化產物為Fe3O4和SiO2 | |
| B. | 氧化劑與還原劑物質的量的之比為2:3 | |
| C. | 當有1.5mol Fe2SiO4參加反應時,轉移的電子為3 mol | |
| D. | 當有1mol CO2參加反應時,被氧化的Fe2SiO4的物質的量為1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 壓強/Mpa 轉化率/% 溫度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 開始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某化學實驗小組想要了解市場上所售食用白醋(主要是醋酸的水溶液)的濃度,現從市場上買來一瓶某品牌食用白醋,用實驗室標準NaOH溶液對其進行滴定.下表是4種常見指示劑的變色范圍:
某化學實驗小組想要了解市場上所售食用白醋(主要是醋酸的水溶液)的濃度,現從市場上買來一瓶某品牌食用白醋,用實驗室標準NaOH溶液對其進行滴定.下表是4種常見指示劑的變色范圍:| 指示劑 | 石蕊 | 甲基橙 | 甲基紅 | 酚酞 |
| 變色范圍(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 實驗次數 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液體積/mL | 26.02 | 25.32 | 25.28 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1的NaHSO3溶液與0.2 mol•L-1的NaClO溶液等體積混合:HSO3-+ClO-=SO42-+Cl-+H+ | |
| B. | 等濃度的Fe2(SO4)3溶液和Ba(OH)2溶液混合:2Fe3++3SO42-+3Ba2++6OH-=2Fe(OH)3↓+3BaSO4↓ | |
| C. | Ca(HCO3)2溶液與少量NaOH溶液反應:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | H218O中投入過氧化鈉:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com