
 某化學實驗小組想要了解市場上所售食用白醋(主要是醋酸的水溶液)的濃度,現從市場上買來一瓶某品牌食用白醋,用實驗室標準NaOH溶液對其進行滴定.下表是4種常見指示劑的變色范圍:
某化學實驗小組想要了解市場上所售食用白醋(主要是醋酸的水溶液)的濃度,現從市場上買來一瓶某品牌食用白醋,用實驗室標準NaOH溶液對其進行滴定.下表是4種常見指示劑的變色范圍:| 指示劑 | 石蕊 | 甲基橙 | 甲基紅 | 酚酞 |
| 變色范圍(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 實驗次數 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液體積/mL | 26.02 | 25.32 | 25.28 |
分析 (1)根據酸堿反應生成了強堿弱酸鹽,溶液呈堿性,應選擇堿性變色范圍內的指示劑; 量取酸應該用酸式滴定管;
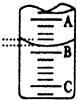
(2)A與C刻度間相差1ml,說明每兩個小格之間是0.1mL,A處的刻度為25,據此確定B的刻度,注意滴定管的上面數值小,下面數值大;
(3)通過觀察溶液顏色變化判斷終點,酚酞在酸性溶液中為無色,達到終點溶液稍顯堿性,變淺紅色;
(4)根據c(酸)=$\frac{c(堿)×V(堿)}{V(酸)}$判斷不當操作對相關物理量的影響;
(5)利用平均值計算醋酸的質量,再根據酸度公式計算其酸度.
解答 解:(1)根據酸堿反應生成了強堿弱酸鹽,溶液呈堿性,應選擇堿性變色范圍內的指示劑,故選酚酞;
白醋是酸,應該用酸式滴定管量取,故答案為:酚酞,酸式滴定管;
(2)A與C刻度間相差1ml,說明每兩個小格之間是0.10mL,A處的刻度為25,A和B之間是四個小格,所以相差0.40mL,則B是25.40mL,
故答案為:25.40;
(3)通過觀察溶液顏色變化判斷終點,所以滴定時眼睛要觀察錐形瓶內溶液顏色變化;滴定時錐形瓶中為酸性溶液,酚酞在酸性溶液中為無色,達到終點溶液稍顯堿性,變淺紅色,則錐形瓶由無色變為淺紅色且半分鐘內不復原,說明達到滴定終點;
故答案為:錐形瓶內溶液顏色變化;錐形瓶由無色變為淺紅色且半分鐘內不復原;
(4)從上表可以看出,第一次實驗中記錄消耗NaOH溶液體積明顯多于后兩次,上面測得的醋酸濃度偏大,
A.實驗結束時俯視刻度線讀取滴定終點時NaOH溶液的體積,導致氫氧化鈉體積偏小,所以所測醋酸濃度偏小,故錯誤;
B.滴定前滴定管尖嘴有氣泡,滴定結束無氣泡,導致氫氧化鈉體積偏大,所以所測醋酸濃度偏大,故正確;
C.盛裝標準液的滴定管裝液前用蒸餾水潤洗過,未用標準液潤洗,導致氫氧化鈉濃度偏小,所以所用氫氧化鈉體積偏大,所測醋酸濃度偏大,故正確;
D.第一次滴定用的錐形瓶用待裝液潤洗過,后兩次未潤洗,潤洗錐形瓶導致醋酸的物質的量偏大,所以使用的氫氧化鈉體積偏大,所測醋酸濃度判斷,故正確;
E.滴定NaOH溶液過快,未充分振蕩,剛看到溶液變色,立刻停止滴定,導致使用的氫氧化鈉體積偏小,所測醋酸濃度偏小,故錯誤;
故答案為:BCD;
(5)第一次誤差較大舍去,醋酸和氫氧化鈉反應的物質的量相等,兩次使用氫氧化鈉的平均體積=$\frac{25.32+25.28}{2}$=25.30mL,
醋酸的物質的量等于氫氧化鈉的物質的量,
所以c(醋酸)=$\frac{n}{V}$=$\frac{25.30×c}{V}$mol/L;
故答案為:$\frac{25.30×c}{V}$.
點評 本題考查酸堿滴定實驗,難度中等,會根據實際需要選取指示劑,注意滴定管上的刻度和量筒上刻度的區別,為易錯點,明確實驗原理、步驟以及誤差分析的方法即可解答.


科目:高中化學 來源: 題型:選擇題
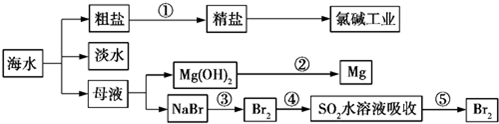
| A. | 除去粗鹽中的SO42-、Ca2+、Mg2+、Fe3+等雜質,①中加入試劑的順序為Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | ②中包含制取MgCl2溶液、無水MgCl2及電解熔融狀態的MgCl2幾個階段 | |
| C. | ③④⑤中溴元素均被氧化 | |
| D. | 蒸餾法是技術最成熟也是最具發展前景的海水淡化方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
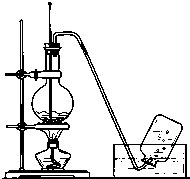 實驗室常用如圖所示裝置制取乙烯,制取時:
實驗室常用如圖所示裝置制取乙烯,制取時:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有碳、氫兩種元素組成的有機化合物稱為烴 | |
| B. | 乙醛和乙酸都含有碳氧雙鍵,二者都能發生加成反應 | |
| C. | 苯可以發生加成反應,但苯中不含有碳碳雙鍵 | |
| D. | 乙醇和苯酚都含有羥基都能發生酯化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
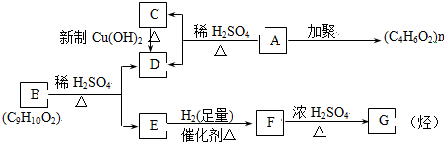
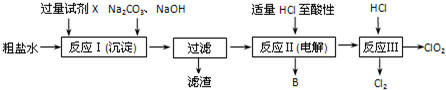
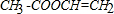 ,B:
,B: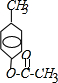 ;
;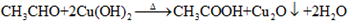 ,
,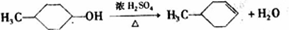 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
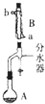 實驗室用乙酸和正丁醇制備乙酸正丁酯的反應如下
實驗室用乙酸和正丁醇制備乙酸正丁酯的反應如下| 化合物 | 相對分子質量 | 密度/g•cm-3 | 沸點/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com