
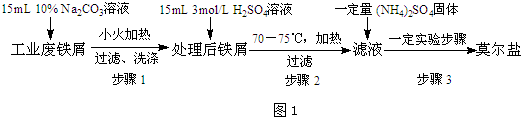
分析 (1)從濾液到得到晶體需要加熱濃縮、冷卻結晶、過濾、洗滌干燥等過程;步驟是溶液的加熱和過濾,結合加熱與過濾基本操作選擇儀器;
(2)水浴加熱便于控制溫度;亞鐵離子易被氧化,少量鐵還原氧化生成的Fe3+;FeSO4在溫度低時溶解度較小;
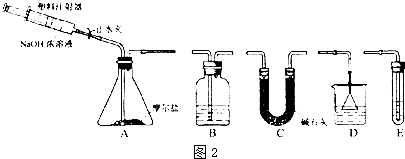
(3)莫爾鹽與氫氧化鈉溶液反應生成氨氣,可用稀硫酸吸收,注意防止倒吸,氫氧化鈉具有強腐蝕性,可與二氧化硅反應;
(4)加入氫氧化鈉溶液時,應先打開止水夾,緩慢推壓注射器活塞,用稀硫酸吸收氨氣,為保證氣體完全吸收,可用注射器向A中注入空氣;
(5)由題給數(shù)據(jù)可知7.84g摩爾鹽中m(H2O)=7.84g-5.68g=2.16g,生成的m(NH3)=0.68g,m(Fe2O3)=1.6g,以此可確定SO42-的質量以及n(NH4+):n(Fe2+):n((SO42-):n(H2O)的比值.
解答 解:(1)廢鐵中含氧化鐵,無需制備前除去,因最終溶液是FeSO4溶液,氧化鐵和硫酸生成硫酸鐵、鐵和硫酸鐵生成硫酸亞鐵,離子方程式為:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,步驟是溶液的加熱和過濾,需要的儀器有:鐵架臺、燒杯、玻璃棒、酒精燈、石棉網,故不需要廣口瓶、漏斗,
故答案為:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+;③⑦;
(2)步驟二實驗需要溫度為:70~75℃,采用水浴加熱便于控制溫度;亞鐵離子易被氧化,少量鐵可還原氧化生成的Fe3+,減少產物中的Fe3+雜質,如果不趁熱過濾就會有FeSO4•7H2O析出;
故答案為:水浴加熱;防止Fe2+被氧化,同時熱過濾可防止硫酸亞鐵以晶體形式析出;
(3)莫爾鹽與氫氧化鈉溶液反應生成氨氣,生成氨氣先用堿石灰干燥,以除去水,然后用稀硫酸在D裝置內吸收氨氣,以防止倒吸,氫氧化鈉具有強腐蝕性,可與二氧化硅反應,則可用注射器加入氫氧化鈉溶液,
故答案為:C;D; NaOH溶液對分液漏斗活塞、旋塞的磨口腐蝕性強;
(4)加入氫氧化鈉溶液時,應先打開止水夾,緩慢推壓注射器活塞,用稀硫酸吸收氨氣,為保證氣體完全吸收,可用注射器向A中注入空氣,使裝置中的氨氣全部進入吸收液,
故答案為:打開止水夾,緩慢推壓注射器活塞;H2SO4溶液;用注射器向A中注入空氣,使裝置中的氨氣全部進入吸收液;
(5)由題給數(shù)據(jù)可知7.84g摩爾鹽中m(H2O)=7.84g-5.68g=2.16g,n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol,
生成的m(NH3)=0.68g,m(Fe2O3)=1.6g,
則n(NH3)=$\frac{0.68g}{17g/mol}$=0.04mol,n(Fe2O3)=$\frac{1.6g}{160g/mol}$=0.01mol,
則m(NH4+)=0.04mol×18g/mol=0.72g,m(Fe2+)=0.02mol×56g/mol=1.12g,
則m(SO42-)=7.84g-2.16g-0.72g-1.12g=3.84g,
n(SO42-)=$\frac{3.84g}{96g/mol}$=0.04mol,
所以n(NH4+):n(Fe2+):n((SO42-):n(H2O)=0.04mol:0.02mol:0.04mol:0.12mol=2:1:2:6,
故答案為:2:1:2:6.
點評 本題考查物質的含量測定,側重于學生的分析能力、計算能力和實驗能力的考查,題目難度不大,注意把握相關實驗基本方法和注意事項.


科目:高中化學 來源: 題型:選擇題
| A. | 甲指著氫氣燃燒的實驗裝置說:“一種物質發(fā)生反應后,如果有水生成,我認為該物質中一定含有氫元素.” | |
| B. | 乙回答:“可能是這樣,但我不能肯定.” | |
| C. | 乙指著實驗桌上一瓶無色氣體說:“這瓶無色的氣體如果點燃后能燃燒并生成水,我認為這是一瓶氫氣.” | |
| D. | 甲回答:“可能是這樣,但我也不能肯定.” |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 SiO2、SO2和CO2都是酸性氧化物,它們的化學性質具有一定的相似性;Mg和Na的化學性質也具有一定相似性.某興趣小組用如圖所示裝置進行Mg與SO2反應的實驗.
SiO2、SO2和CO2都是酸性氧化物,它們的化學性質具有一定的相似性;Mg和Na的化學性質也具有一定相似性.某興趣小組用如圖所示裝置進行Mg與SO2反應的實驗.| 序號 | 實驗步驟 | 預期現(xiàn)象和結論 |
| 1 | 取少量反應后所得固體于試管中 | |
| 2 | 向試管中的固體慢慢滴加2mol/L 鹽酸至過量,試管口塞上導管的單孔塞,并將導管通入盛有品紅的試管中 | 若試管中的固體完全溶解,則丙同學推測正確.若試管中的固體未完全溶解,且品紅溶液褪色,則乙同學推測正確. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑤ | B. | ②④⑤⑥⑦ | C. | ②④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com