
分析 (1)m(樣品)×ω(CuFeS2)×CuFeS2中S元素的質量分數=m(S);
(2)①由反應可知,最終CuFeS2與O2反應的最終成為FeO、Cu、SO2,根據原子守恒計算n(FeO)、n(SO2),根據O原子守恒可知2n(O2)=n(FeO)+n(SO2);
②根據方程式計算6mol CuFeS2消耗O2的物質的量、生成Cu2S的物質的量,進而計算剩余O2的物質的量.根據2Cu2S+3O2=2Cu2O+2SO2計算反應的Cu2S的物質的量、生成Cu2O的物質的量,進而計算剩余Cu2S的物質的量,再根據2Cu2O+Cu2S→6Cu+SO2進行過量計算.
解答 解:(1)12.5g×ω(CuFeS2)×=3.6g,解得ω(CuFeS2)=82.8%,故答案為:82.8%;
(2)①由反應可知,最終CuFeS2與O2反應的最終成為FeO、Cu、SO2,根據原子守恒n(FeO)=n(CuFeS2)=6mol,n(SO2)=2n(CuFeS2)=12mol,根據O原子守恒可知2n(O2)=n(FeO)+2n(SO2)=6mol+12mol×2,故n(O2)=15mol,
答:消耗O2的物質的量為15mol;
②2CuFeS2+4O2 =Cu2S+3SO2+2FeO,
6mol 12mol 3mol
故剩余氧氣為14.25mol-12mol=2.25mol,生成Cu2S為3mol,
2Cu2S+3O2=2Cu2O+2SO2;
3mol 4.5mol
故氧氣不足,故氧氣完全反應,按照氧氣計算,
2Cu2S+3O2 =2Cu2O+2SO2
x 2.25mol y
生成Cu2O為2.25mol×$\frac{2}{3}$=1.5mol
消耗的Cu2S為2.25mol×$\frac{2}{3}$=1.5mol,則剩余Cu2S為3mol-1.5mol=1.5mol,
2Cu2O+Cu2S=6Cu+SO2;
1.5mol 1.5mol z
故氧化亞銅完全反應,則生成銅z=1.5mol×$\frac{6}{2}$=4.5mol,
故答案為:4.5.
點評 本題考查混合物的有關計算,題目過程復雜,計算量很大,為易錯題目,對學生的心理素質有較高的要求,注意原子守恒計算與過量計算.


 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源: 題型:多選題
| A. | 35Cl原子所含質子數為18 | |
| B. | $\frac{1}{18}$ mol的1H35Cl分子所含中子數約為6.02×1023 | |
| C. | 3.5 g的35Cl2氣體的體積為2.24 L | |
| D. | 35Cl2氣體的摩爾質量為70 g•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.5 mol/L | B. | 0.4 mol/L | C. | 0.3 mol/L | D. | 0.2 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
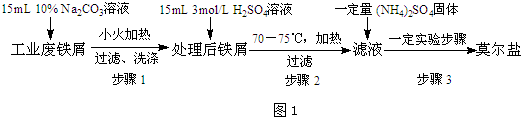
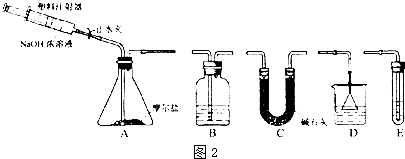
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃度為0.1mol•L-1 CH3COOH溶液,加水稀釋,則$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$減小 | |
| B. | 濃度為0.1mol•L-1 CH3COOH溶液,升高溫度,Ka (CH3COOH)不變,但醋酸的電離程度增大 | |
| C. | 在稀AgNO3溶液中先加入過量0.1mol/L NaCl溶液,再加入少量0.1mol/L Na2S溶液,先產生白色沉淀,后出現黑色沉淀,說明Ksp(AgCl)>Ksp(Ag2S) | |
| D. | 在恒容密閉容器中,反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0達到平衡后,使用高效催化劑,正反應速率增加,逆反應速率減小,平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 石灰水、裂化汽油 | B. | NaHS溶液、SO2 | ||
| C. | NaCl溶液、NaI溶液 | D. | CaCl2溶液、Na2S溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 A,B,C是三種短周期元素的單質,甲、乙是兩種常見的化合物.這些單質和化合物之間存在如圖所示關系.寫出符合如圖關系的A,B,C的化學式,(1)~(3)中的A不在同一主族.
A,B,C是三種短周期元素的單質,甲、乙是兩種常見的化合物.這些單質和化合物之間存在如圖所示關系.寫出符合如圖關系的A,B,C的化學式,(1)~(3)中的A不在同一主族.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含0.1NA個CO32-的Na2CO3固體的質量為10.6g | |
| B. | 含1mol HCl的鹽酸與足量Fe反應,Fe失去的電子總數為2NA | |
| C. | 水的摩爾質量就是NA個水分子的質量之和 | |
| D. | 2mol氦氣含有電子數為8NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com