
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol (燃燒熱) | |
| B. | 已知C(石墨,s)═C(金剛石,s)△H>0,則金剛石比石墨穩定 | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反應熱) | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,則△H1>△H2 |
分析 A.生成氣態水不是穩定氧化物;
B.能量低的物質更穩定;
C.熱化學方程式中注明物質的狀態,焓變的數字、單位、正負號;
D.C的燃燒反應為放熱反應,完全燃燒放出的熱量多,但焓變為負.
解答 解:A.生成氣態水不是穩定氧化物,則燃燒熱的熱化學方程式為C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367.0 kJ/mol,故A錯誤;
B.能量低的物質更穩定,由△H>0,可知石墨能量低,則石墨穩定,故B錯誤;
C.熱化學方程式中注明物質的狀態,焓變的數字、單位、正負號,則S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反應熱)合理,故C正確;
D.C的燃燒反應為放熱反應,完全燃燒放出的熱量多,但焓變為負,由2C(s)+2O2(g)═2CO2(g)△H1、2C(s)+O2(g)═2CO(g)△H2,則△H1<△H2,故D錯誤;
故選C.
點評 本題考查反應熱與焓變,為高頻考點,把握反應中能量變化、燃燒熱、熱化學方程式書寫為解答的關鍵,側重分析與應用能力的考查,注意焓變的判斷,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
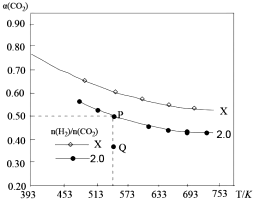 在兩個固定容積均為1L密閉容器中以不同的氫碳比[n(H2):n(CO2)]充入H2和CO2,在一定條件下發生反應:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡轉化率a(CO2)與溫度的關系如圖所示.下列說法正確的是( )
在兩個固定容積均為1L密閉容器中以不同的氫碳比[n(H2):n(CO2)]充入H2和CO2,在一定條件下發生反應:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡轉化率a(CO2)與溫度的關系如圖所示.下列說法正確的是( )| A. | 該反應在高溫下自發進行 | |
| B. | 氫碳比:X<2.0 | |
| C. | 氫碳比為2.0時.Q點v(H2)逆小于P點的v(H2)逆 | |
| D. | 向處于P點狀態的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
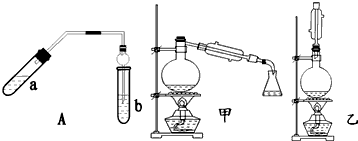
| 實驗編號 | 試管a中試劑 | 試管b中試劑 | 測得有機層 的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1濃硫酸 | 飽和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
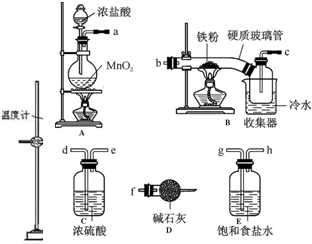

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
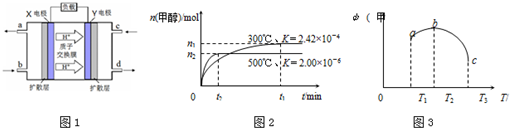
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1分子H2和Cl2反應,放出熱量184.6 kJ | |
| B. | 1 mol H2(g)完全反應生成2 mol HCl(g),放出的熱量為184.6 kJ | |
| C. | 在101 kPa、25℃的條件下,1 mol H2(g)和1 mol Cl2(g)完全反應生成2 mol HCl(g)放出的熱量為184.6 kJ | |
| D. | 在101 kPa、25℃的條件下,1 mol H2(g)和1 mol Cl2(g)完全反應生成2 mol HCl(g)吸收的熱量為184.6 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 開發廢舊電池綜合利用技術,防止重金屬鹽對土壤水資源造成污染 | |
| B. | 綠色化學的核心是應用化學原理對環境污染進行治理 | |
| C. | 倡導低碳生活,使用太陽能、風能等代替化石燃料,可減少溫室氣體的排放 | |
| D. | 垃圾是放錯地方的資源,應分類回收利用 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com