氨是一種重要的化工產(chǎn)品,是氮肥工業(yè)、有機合成工業(yè)以及制造硝酸、銨鹽 和純堿的原料,也是一種常用的制冷劑.
(1)實驗室制備氨氣的化學反應(yīng)方程式為
.
(2)工業(yè)合成氨的反應(yīng)方程式為:N
2(g)+3H
2(g)?2NH
3(g)△H.
圖I是合成氨反應(yīng)的 能量與反應(yīng)過程相關(guān)圖(未使用催化劑);圖Ⅱ是合成気反應(yīng)在2L容器中、相同投料情況下、其它條件都不變時,某一反應(yīng)條件的改變對反應(yīng)的影響圖.
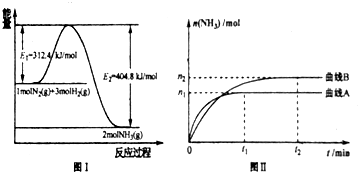
下列說法正確的是
.
A.△H=-92.4kJ/mol
B.使用催化劑會使E
1的數(shù)值增大
C.為了提高轉(zhuǎn)化率,工業(yè)生產(chǎn)中反應(yīng)的度越低越好
D.圖II是不同壓強下反應(yīng)體系中氨的物質(zhì)的量與反應(yīng)時間關(guān)系圖.且P
A<P
BE.圖II是不同溫度下反應(yīng)體系中氨的物質(zhì)的量與反應(yīng)時間關(guān)系圖,且T
A>T
B;
F.該反應(yīng)的平銜常數(shù)K
A<K
BG.在曲線A條件下,反應(yīng)從開始到平衡,消耗N
2的平均速率為
mol?L
-1?min
-1(3)-定溫度下,向一個容積為2L的密閉容器中通入2mol N
2和7mol H
2,達到平衡時 測得容器內(nèi)的壓強為起始時的
倍,則此溫度下的平衡常數(shù)為
.在同一溫度,同一容器中,將起始物質(zhì)改為a mol N
2、b mol H
2、c mol NH
3(a,b,c均不為零)欲使4平衡混合物中各物質(zhì)的質(zhì)量與原平衡相同,則a,b,c滿足的關(guān)系為(用含a,b,c的表達式表示)
.且欲使反應(yīng)在起始時向逆反應(yīng)方向進行,c的取值范圍是
.
(4)已知H
2(g)的燃燒熱為2S5.8kJ/mol.試寫出表示NH
3(g)燃燒熱的熱化學反應(yīng)方程式
以氨氣為燃料可以設(shè)計制氨燃料電池(電極材料均為惰性電極,KOH溶液作電解質(zhì)溶液)該電池負極電極反應(yīng)式為-
經(jīng)測定,該電作過程中每 放出1mol N
2實際提供460kJ的電能,則該燃料電池的實際效率為
(燃料電池的實標效率是指電池實際提供的電能占燃料電池反應(yīng)所能釋放出的全部能量的百分數(shù)).







 圖中X、Y、Z、W是地殼含量前四位(不按順序)的元素組成的單質(zhì),其它為化合物,A有磁性.它們之間存在如下轉(zhuǎn)化關(guān)系(部分產(chǎn)物已略去).
圖中X、Y、Z、W是地殼含量前四位(不按順序)的元素組成的單質(zhì),其它為化合物,A有磁性.它們之間存在如下轉(zhuǎn)化關(guān)系(部分產(chǎn)物已略去).