
| A. | 8g | B. | 16g | C. | 24g | D. | 32g |
分析 根據C和氧氣的反應:C+O2=CO2①、2C+O2=2CO②可知,反應①是氣體的物質的量即壓強不變的反應,而反應②是氣體的物質的量即壓強增大2倍的反應,由于測得相同條件下的壓強是反應前的1.6倍,故反應①②一定同時發生,即氧氣的量不足,和9.6g碳完全反應生成CO2和CO的混合物.
9.6g碳的物質的量n=$\frac{9.6g}{12g/mol}$=0.8mol.
設氧氣的物質的量為xmol,生成的CO2的物質的量為ymol,生成的CO的物質的量為zmol,根據C原子守恒、O原子守恒和壓強的改變來列式解答.
解答 解:根據C和氧氣的反應:C+O2=CO2①、2C+O2=2CO②可知,反應①是氣體的物質的量即壓強不變的反應,而反應②是氣體的物質的量即壓強增大2倍的反應,由于測得相同條件下的壓強是反應前的1.6倍,故反應①②一定同時發生,即氧氣的量不足,和9.6g碳完全反應生成CO2和CO的混合物.
9.6g碳的物質的量n=$\frac{9.6g}{12g/mol}$=0.8mol.
設氧氣的物質的量為xmol,生成的CO2的物質的量為ymol,生成的CO的物質的量為zmol.
根據C原子守恒可有:y+z=0.8mol ①
根據O原子守恒可有:2y+z=2x ②
根據壓強變為原來的1.6倍可有:y+z=1.6x ③
解①②③可得x=0.5mol
故氧氣的質量m=nM=16g.
故選B.
點評 本題考查了根據化學方程式的有關計算,根據反應特點分析出C和氧氣的反應產物中既有CO2又有CO是解題關鍵,難度不大.


 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案科目:高中化學 來源: 題型:實驗題
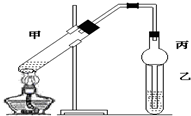
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通入過量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入過量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入過量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
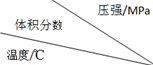 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 5個 | B. | 4個 | C. | 3個 | D. | 2個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 時間/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s間的平均反應速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化轉化器對廢氣的轉化速率在冬季時比夏季時高 | |
| C. | 選用更有效的催化劑可以提高污染物的轉化率 | |
| D. | 該溫度下,此反應的平衡常數K=5.0×103 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | x值為1 | B. | 混合氣體的密度增大 | ||
| C. | 平衡時N的濃度為 0.6 mol/L | D. | N的轉化率為80% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷的燃燒熱△H=-890.3kJ/mol,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定條件下,將0.5molN2和1.5molH2置于密閉容器中充分反應生成NH3放熱akJ,其熱化學方程式為:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反應的中和熱△H=-57.3kJ/mol,則H2SO4和Ba(OH)2反應的中和熱△H=-114.6kJ/mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com