
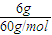 =0.1mol,根據c=
=0.1mol,根據c=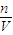 計算物質的量濃度;根據α=
計算物質的量濃度;根據α=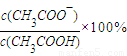 計算電離度,根據k=
計算電離度,根據k= 計算電離平衡常數,結合外界條件對弱電解質的電離平衡的影響判斷電離度的變化.
計算電離平衡常數,結合外界條件對弱電解質的電離平衡的影響判斷電離度的變化.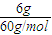 =0.1mol,
=0.1mol,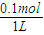 =0.1mol/L,
=0.1mol/L,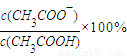 =
=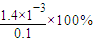 =1.4%,
=1.4%,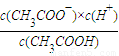 =
=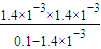 =1.99×10-5,
=1.99×10-5,

科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com