
| A. | 常溫常壓下,32g O2和16g O3的混合物中,含有O原子數目為2NA | |
| B. | 標準狀況下,1mol Na2O 和1mol Na2O2的混合物中,含有離子總數為7NA | |
| C. | 1mol NaHSO4溶于水或受熱熔化,電離出來的離子數目均為2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,轉移的電子數目為 $\frac{2}{3}$NA |
分析 A、依據n=$\frac{m}{M}$計算物質的量結合氧元素守恒計算氧原子數;
B、過氧化鈉中陰離子為過氧根離子,1mol Na2O和1molNa2O2中都含有的陰、陽離子的物質的量為3mol;
C、熔融的NaHSO4中含有的陽離子只有鈉離子;
D、若用K35Cl03與H37Cl作用,則發生KClO3+6HCl=KCl+3C12↑+3H2O,35Cl得到電子,37Cl失去電子,生成3molC12中有1mol35Cl.
解答 解:A、常溫常壓下,32g O2和O3的混合物中含有原子數=$\frac{32g}{16g/mol}$×NA=2NA,故A正確;
B、過氧化鈉中陰離子為過氧根離子,1mol Na2O和1molNa2O2的混合物中含有4mol鈉離子和2mol陰離子,總共含有6mol陰陽離子,含有的陰、陽離子總數是6NA,故B錯誤;
C、1mol熔融硫酸氫鈉電離出1mol鈉離子和1mol硫酸氫根離子,電離出來的離子數目為2NA,溶于水電離出鈉離子、氫離子和硫酸根離子,所以1mol硫酸氫鈉水溶液中電離出離子數為3mol,即3NA,故C錯誤;
D、氯酸鉀中Cl元素的化合價由+5價降低為0,該反應中轉移電子數為5,生成的氯氣相對分子質量約為$\frac{37×5+35}{6}$×2=73.3,若生成71g Cl2,轉移的電子數目=$\frac{71g}{73.3g/mol}×5$=4.86mol,故D錯誤;
故選A.
點評 本題考查阿伏加德羅常數的有關計算和判斷,題目難度中等,掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,準確弄清分子、原子、離子和物質的構成關系題.


科目:高中化學 來源: 題型:選擇題
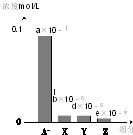 常溫下,0.2mol/L的一元酸HA與等濃度的NaOH溶液等體積混合后,所得溶液中部分微粒組分及濃度如圖所示(a、b、d、e均為不超過1的正數),則下列說法正確的是( )
常溫下,0.2mol/L的一元酸HA與等濃度的NaOH溶液等體積混合后,所得溶液中部分微粒組分及濃度如圖所示(a、b、d、e均為不超過1的正數),則下列說法正確的是( )| A. | 該溶液pH=7 | B. | 該溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | HA為強酸 | D. | 圖中X表示HA,Y表示OH-,Z表示H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙二醇和丙三醇是1:1 | B. | 乙醇和乙二醇是1:2 | ||
| C. | 甲醇和乙醇是5:1 | D. | 甲醇和乙醇是4:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
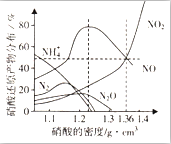 某些金屬與不同密度的硝酸反應時,往往生成多種不同價態的還原產物,如圖是在相同條件下,各種不同密度的硝酸和鐵反應時,還原產物的分布圖.通過圖象判斷下列說法不正確的是( )
某些金屬與不同密度的硝酸反應時,往往生成多種不同價態的還原產物,如圖是在相同條件下,各種不同密度的硝酸和鐵反應時,還原產物的分布圖.通過圖象判斷下列說法不正確的是( )| A. | 稀硝酸與鐵反應,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸與鐵反應,還原產物百分率最多的是NH4+ | |
| C. | 某硝酸試劑瓶的標簽注明:密度為1.26g•cm-3,質量分數50.0%;若取該試劑10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 當硝酸的密度為1.36g•cm-3時,過量鐵與硝酸反應,消耗的鐵與被還原的硝酸物質的量之比為1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
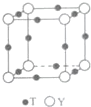 原子序數依次增大的X、Y、Z、G、Q、R、T七種元素,核電荷數均小于36.已知X的一種1:2型氫化物分子中既有σ鍵又有π鍵,且所有原子共平面;Z的L層上有2個未成對電子;Q原子s能級與p能級電子數相等;G為金屬元素;R單質是制造各種計算機、微電子產品的核心材料;T處于周期表的ds區,且最外層只有一個電子.
原子序數依次增大的X、Y、Z、G、Q、R、T七種元素,核電荷數均小于36.已知X的一種1:2型氫化物分子中既有σ鍵又有π鍵,且所有原子共平面;Z的L層上有2個未成對電子;Q原子s能級與p能級電子數相等;G為金屬元素;R單質是制造各種計算機、微電子產品的核心材料;T處于周期表的ds區,且最外層只有一個電子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔點/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 堆積方式 | 晶胞棱長(cm) |
| Ⅰ | 面心立方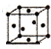 | a |
| Ⅱ | 體心立方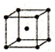 | b |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
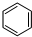 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高溫\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高溫\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$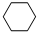 (g)
(g) 
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 取浸取液少許,滴入AgNO3溶液有白色沉淀產生,則可能含有Cl- | |
| B. | 取浸取液少許,加入Cu和濃H2SO4,試管口有紅棕色氣體產生,則可能含有NO3- | |
| C. | 取浸取液少許,滴入硝酸酸化的BaCl2溶液,有白色沉淀產生,則一定含SO42- | |
| D. | 用潔凈的鉑絲棒蘸取浸取液,在酒精燈外焰上灼燒,焰色呈黃色,則一定含有Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 逸出ClO2使生成物濃度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com