
 原子序數依次增大的X、Y、Z、G、Q、R、T七種元素,核電荷數均小于36.已知X的一種1:2型氫化物分子中既有σ鍵又有π鍵,且所有原子共平面;Z的L層上有2個未成對電子;Q原子s能級與p能級電子數相等;G為金屬元素;R單質是制造各種計算機、微電子產品的核心材料;T處于周期表的ds區,且最外層只有一個電子.
原子序數依次增大的X、Y、Z、G、Q、R、T七種元素,核電荷數均小于36.已知X的一種1:2型氫化物分子中既有σ鍵又有π鍵,且所有原子共平面;Z的L層上有2個未成對電子;Q原子s能級與p能級電子數相等;G為金屬元素;R單質是制造各種計算機、微電子產品的核心材料;T處于周期表的ds區,且最外層只有一個電子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔點/K | 993 | 1539 | 183 |
分析 X的一種氫化物分子中既有σ鍵又有π鍵,說明分子里有雙鍵或參鍵,X的一種氫化物為1:2型且所有原子共平面,所以X應為碳元素,它的1:2型氫化物為乙烯;Z的L層上有2個未成對電子,即核外電子排布為1s22s22p2或1s22s22p4,X、Y、Z原子序數依次增大,所以Z為氧元素,且Y為氮元素;Q原子s能級與p能級電子數相等,則Q的核外電子排布為1s22s22p4或1s22s22p63s2,由于Q的原子序數比Z大,所以Q的電子排布為1s22s22p63s2,即Q為鎂元素;而G為金屬元素且原子序數介于氧和鎂元素之間,所以G為鈉元素;R單質是制造各種計算機、微電子產品的核心材料,R為硅元素;T處于周期表的ds區,且最外層只有一個電子,則T為Cu,據此答題.
解答 解:X的一種氫化物分子中既有σ鍵又有π鍵,說明分子里有雙鍵或參鍵,X的一種氫化物為1:2型且所有原子共平面,所以X應為碳元素,它的1:2型氫化物為乙烯;Z的L層上有2個未成對電子,即核外電子排布為1s22s22p2或1s22s22p4,X、Y、Z原子序數依次增大,所以Z為氧元素,且Y為氮元素;Q原子s能級與p能級電子數相等,則Q的核外電子排布為1s22s22p4或1s22s22p63s2,由于Q的原子序數比Z大,所以Q的電子排布為1s22s22p63s2,即Q為鎂元素;而G為金屬元素且原子序數介于氧和鎂元素之間,所以G為鈉元素;R單質是制造各種計算機、微電子產品的核心材料,R為硅元素;T處于周期表的ds區,且最外層只有一個電子,則T為Cu.
(1)Y為氮元素,核外電子排布式為1s22s22p3,所以7種不同運動狀態的電子,T為Cu元素,它的核外電子排布式為1s22s22p63s23p63d104s1,價電子排布為3d104s1,
故答案為:7;3d104s1;
(2)OCN-與CO2互為等電子體,所以它們結構相似,在二氧化碳中碳原子的價層電子對數為2,所以碳的雜化方式為sp雜化,則OCN-中C原子也是sp雜化,
故答案為:sp雜化;
(3)化合物甲為二氧化硅,在二氧化硅晶體中,每個硅原子周圍有四個Si-O 鍵,所以1mol二氧化硅中含有4molSi-O 鍵,SiO2與HF反應的方程式為:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的價層電子對數為4+$\frac{4-1×4}{2}$=4,沒有孤電子對,所以SiF4的空間構型為正四面體,H2O中氧原子的價層電子對數為2+$\frac{6-1×2}{2}$=4,有2對孤電子對,所以H2O的空間構型為V形,
故答案為:4;正四面體形、V形;
(4)在NaF、MgF2、SiF4中NaF與MgF2為離子晶體,SiF4為分子晶體,故SiF4的熔點低,Mg2+的半徑比Na+的半徑小,電荷數高,晶格能MgF2>NaF,故MgF2的熔點比NaF高,
故答案為:NaF與MgF2為離子晶體,SiF4為分子晶體,故SiF4的熔點低,Mg2+的半徑比Na+的半徑小,電荷數高,晶格能MgF2>NaF,故MgF2的熔點比NaF高;
(5)向硫酸銅溶液中逐滴加入氨水至過量,開始生成氫氧化銅沉淀,后來沉淀溶解生成四氨合銅離子,其反應的離子方程式為:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案為:Cu2++2 NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
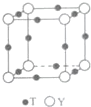
(6)與Y離子最近的T離子處于棱上且故Y離子對稱,故Y離子配位數為6;
晶胞中N原子數目為8×$\frac{1}{8}$=1,Cu原子數目為12×$\frac{1}{4}$=3,則晶胞質量為$\frac{14+64×3}{{N}_{A}}$g,晶胞體積為(a cm)3,則:(a cm)3×bg•cm-3=$\frac{14+64×3}{{N}_{A}}$g,整理得NA=$\frac{206}{b{a}^{3}}$,
故答案為:6;$\frac{206}{b{a}^{3}}$.
點評 本題是對物質結構的考查,涉及核外電子的排布及運動狀態、等電子體、分子構型、晶體類型與性質、配合物、晶胞計算等,注意理解均攤法有關晶胞計算,題目難度中等.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{62}^{144}$Sm與${\;}_{62}^{150}$Sm互為同素異形體 | |
| B. | ${\;}_{62}^{144}$Sm與${\;}_{62}^{150}$Sm具有相同核外電子排布 | |
| C. | ${\;}_{62}^{144}$Sm與${\;}_{62}^{150}$Sm的性質完全相同 | |
| D. | ${\;}_{62}^{144}$Sm與${\;}_{62}^{150}$Sm的質子數不同,但中子數相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 選項 | 操作 | 現象 | 結論 |
| A | 向FeSO4溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有氧化性 |
| B | 向Na2SiO3溶液中通入適量的CO2 | 產生白色膠狀物質 | 酸性:H2CO3>H2SiO3 |
| C | 將新制氯水和NaBr溶液在試管中混合后,加入CCl4,振蕩,靜置 | 下層溶液呈橙紅色 | 氧化性:Cl2>Br2 |
| D | 向Al2(SO4)3溶液中滴加過量氨水 | 溶液先渾濁后澄清 | Al3+與NH3•H2O不能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KNO3只發生氧化反應 | B. | 反應消耗12g C時電子轉移5mol | ||
| C. | 還原產物只有K2S和 N2 | D. | 被氧化與被還原的S為1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該電池不宜在高溫下工作 | |
| B. | 若該電池為酸性介質,正極反應式為:O2+4e-+4H+═2H2O | |
| C. | 放電過程中,電池內陽離子向正極遷移 | |
| D. | 若該電池為堿性介質,以葡萄糖為原料并完全氧化,負極反應式為:C6H12O6-24e-+6H2O═6CO2↑+24H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,32g O2和16g O3的混合物中,含有O原子數目為2NA | |
| B. | 標準狀況下,1mol Na2O 和1mol Na2O2的混合物中,含有離子總數為7NA | |
| C. | 1mol NaHSO4溶于水或受熱熔化,電離出來的離子數目均為2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,轉移的電子數目為 $\frac{2}{3}$NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用LED照明燈屬于“低碳生活”方式 | |
| B. | 在家用電熱水器不銹鋼內膽鑲嵌鎂棒,以防止內膽被侵蝕 | |
| C. | 施用適量石灰乳可降低鹽堿地(含較多NaCl,Na2CO3) | |
| D. | 研制高性能的耐磨輪胎,可減少細顆粒物(PM2.5)的產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ① |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com