
| A. | X、Y、Z三種元素的簡單離子半徑逐漸增大 | |
| B. | W、Y、Z三種元素可形成一種離子化合物,其中各原子均滿足8電子穩定結構 | |
| C. | W和Y、Y和Z均能形成原子個數比為1:1的化合物,這兩種化合物中均含有極性共價鍵和非極性共價鍵 | |
| D. | 相同條件下,Z的最高價氧化物對應的水化物的pH大于W、X、Y三種元素形成的化合物的溶液 |
分析 X是空氣中含量最多的元素,應為N元素;Y是地殼含量最多的元素,Y為O元素;W和Z原子的最外層電子數相等,Z、W為同主族元素,且W和Z的核外電子數之和為12,則W為H元素,Z為Na元素;結合元素對應單質、化合物的性質以及元素周期律的遞變規律解答該題.
解答 解:X是空氣中含量最多的元素,應為N元素;Y是地殼含量最多的元素,Y為O元素;W和Z原子的最外層電子數相等,Z、W為同主族元素,且W和Z的核外電子數之和為12,則W為H元素,Z為Na元素;
A.N、O、Na三種元素的簡單離子半徑:N3->O2->Na+,故A錯誤;
B.H、O、Na三種元素可形成一種離子化合物NaOH,其中O、Na原子均滿足8電子穩定結構,H原子不滿足,故B錯誤;
C.H和O、O和Na,分別形成H2O2、Na2O2,前者含有極性鍵和非極性鍵,后者含有離子鍵和非極性鍵,故C錯誤;
D.Z的最高價氧化物對應的水化物為NaOH,顯堿性,W、X、Y三種元素形成的化合物為HNO3或NH4NO3,溶液顯酸性,故D正確.
故選D.
點評 本題考查原子結構與元素周期律知識,題目難度中等,把握原子的結構特點為解答該題的關鍵,注意元素周期律的遞變規律的掌握.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6.02×1022個Na+ | B. | 0.1mol NaCl | ||
| C. | 1L 0.1mol•L-1 Na0H溶液 | D. | 28.6g Na2CO3•10H20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 的單體是:
的單體是: .
. 的單體是:CH3CH=CH2、CH2=CH2.
的單體是:CH3CH=CH2、CH2=CH2.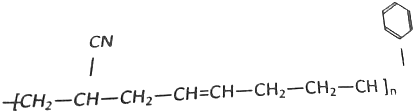 合成此高分子化合物用了三種單體,這三種單體的結構簡式分別是CH2=CH-CN、CH2=CH-CH=CH2、
合成此高分子化合物用了三種單體,這三種單體的結構簡式分別是CH2=CH-CN、CH2=CH-CH=CH2、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.50mol•L-1 | B. | 0.40mol•L-1 | C. | 0.20mol•L-1 | D. | 0.90mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素性質呈周期性變化的根本原因是元素原子半徑大小呈周期性變化 | |
| B. | 碘單質溶于酒精時,共價鍵被破壞 | |
| C. | 任何原子或離子的組成中都含有質子 | |
| D. | 同位素的不同核素物理、化學性質完全相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素B、C、D的簡單氫化物中化學鍵類型相同 | |
| B. | 原子半徑A>B>C>D>E | |
| C. | 由元素A、E形成的單質晶體類型相同 | |
| D. | AB形成的化合物中只可能含離子鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com