
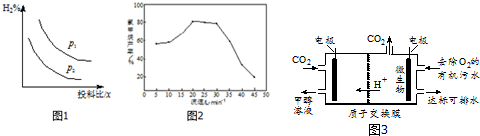
分析 (1)化學平衡常數指在一定溫度下,可逆反應達到平衡時,各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值;
正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,氫氣的含量降低;
(2)根據蓋斯定律,由已知熱化學方程式乘以適當的系數進行加減構造目標熱化學方程式,反應熱也進行相應的計算;
當△G=△H-T△S<0,反應可以自發進行;
流速過高反應物與催化劑的接觸時間過短,原料利用率降低;
主、副反應中都有水生成,對主、副反應有抑制作用,提高CH3Cl純度的同時,也降低了其產率;
(3)陰極發生還原反應,由電解池圖結構可知,二氧化碳獲得電子,在氫離子參與反應條件下生成甲醇.
解答 解:(1)可逆反應:CO(g)+2H2(g)?CH3OH(g),其平衡常數表達式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;
由圖可知,壓強P1時的百分含量大于壓強P2的百分含量,由于正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,氫氣的含量降低,故壓強P1<P2,
故答案為:$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;<;
(2)已知:①NH4Cl(s)=NH3(g)+HCl(g)△H=+163.9kJ•mol-1
②HCl(g)+CH3OH(g)→CH3Cl(g)+H2O(g)△H=-31.9kJ•mol-1
根據蓋斯定律,①+②可得:NH4Cl(s)+CH3OH(g)→NH3(g)+CH3Cl(g)+H2O(g)△H=+132kJ•mol-1;
當△G=△H-T△S<0,正反應為吸熱反應,由于反應△S>0,再高溫下可以自發進行;
流流速過高反應物與催化劑的接觸時間過短,原料利用率降低,導致產率降低;
主、副反應中都有水生成,對主、副反應有抑制作用,提高CH3Cl純度的同時,也降低了其產率;
故答案為:NH4Cl(s)+CH3OH(g)→NH3(g)+CH3Cl(g)+H2O(g)△H=+132kJ•mol-1;△S>0;流速過高反應物與催化劑的接觸時間過短,原料利用率降低,導致產率降低;對主副反應有抑制作用,提高CH3Cl純度的同時,也降低了其產率;
(3)陰極發生還原反應,由電解池圖結構可知,二氧化碳獲得電子,在氫離子參與反應條件下生成甲醇,陰極電極反應式為:CO2+6H++6e-=CH3OH+H2O,
故答案為:CO2+6H++6e-=CH3OH+H2O.
點評 本題考查化學平衡常數含義及影響因素、熱化學方程式的書寫、可逆反應條件控制、電極反應式書寫等,側重考查學生對知識的遷移應用,難度中等.


科目:高中化學 來源: 題型:選擇題
 如圖是氯化銫晶體的晶胞,已知晶體中2個最近的Cs+離子核間距為a cm,氯化銫的摩爾質量為M,NA為阿伏加德羅常數,則氯化銫晶體的密度為( )
如圖是氯化銫晶體的晶胞,已知晶體中2個最近的Cs+離子核間距為a cm,氯化銫的摩爾質量為M,NA為阿伏加德羅常數,則氯化銫晶體的密度為( )| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$g.cm-3 | B. | $\frac{M{a}^{3}}{8{N}_{A}}$gcm-3 | C. | $\frac{M}{{N}_{A}•{a}^{3}}$g.cm-3 | D. | $\frac{Ma}{{N}_{A}}$g.cm |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向淀粉水解液中滴加碘水,檢驗淀粉是否已經水解 | |
| B. | 利用多次滴加Na2SO4溶液能夠提純蛋白質 | |
| C. | 加新制Cu(OH)2懸濁液加熱,可檢驗糖尿病人尿液中的葡萄糖 | |
| D. | 除去甲苯中含有的少量苯酚,可加入NaOH溶液振蕩后,靜置分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氮分子的電子式 N:::N | B. | 鎂原子的原子結構示意圖 | ||
| C. | 質量數是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的結構簡式 C2H5OH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 開始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
 H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 離子 | Fe2+ | Fe3+ | Cu2+ |
| 開始沉淀時的pH(初始濃度為1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全時的pH | 9.7 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 原子半徑:A<B | |
| B. | 原子序數:A<B | |
| C. | 元素所在的周期數:A>B | |
| D. | A的最高正價與B的最低負價的絕對值一定相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com