
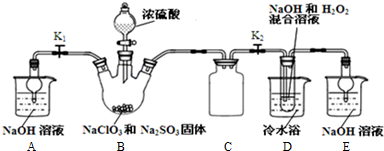
分析 裝置B中制備得到ClO2,所以B中反應為NaClO3和Na2SO3在濃H2SO4的作用生成 ClO2和Na2SO4,二氧化氯和氫氧化鈉反應生成NaClO2,B中可能發生Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O,產生的SO2 被帶入D中,SO2與H2O2 反應生成硫酸鈉,由題目信息可知,應控制溫度38℃~60℃,高于60℃時NaClO2分解成NaClO3和NaCl;裝置C的作用是安全瓶,有防倒吸作用,從裝置D的溶液獲得NaClO2晶體,需要蒸發結晶、趁熱過濾、洗滌、干燥,裝置AE是吸收多余氣體防止污染,
(1)用50%雙氧水配制30%的H2O2溶液,需要的儀器有量筒、燒杯、玻璃棒、膠體滴管;
裝置D中發生氣體反應,裝置內壓強降低,裝置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)裝置B中制備得到ClO2,裝置D反應后的溶液獲得NaClO2晶體,裝置D中生成NaClO2,Cl元素的化合價降低,雙氧水應表現還原性,有氧氣生成,結合原子守恒可知,還有水生成,配平書寫方程式;B制得的氣體中含有SO2,在裝置D中被氧化生成硫酸,可以用利用硫酸鋇是白色沉淀檢驗硫酸根;B中可能發生Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O,產生的SO2 被帶入D中,SO2與H2O2 反應生成硫酸鈉;
(3)從溶液中制取晶體,一般采用蒸發結晶、過濾、洗滌、干燥的方法,注意溫度控制;
(4)由題目信息可知,應控制溫度38℃~60℃,高于60℃時NaClO2分解成NaClO3和NaCl;
(5)①碘遇淀粉變藍色,反應結束時,碘反應完全,滴加最后一滴Na2S2O3標準液時溶液藍色恰好褪去且半分鐘內不復原,說明到達滴定終點;
②根據化學反應可得關系式:NaClO2~2I2~4S2O32-,令樣品中NaClO2的物質的量x,根據關系式計算.
解答 解:(1)用50%雙氧水配制30%的H2O2溶液,需要的儀器有量筒、燒杯、玻璃棒、膠體滴管,所以還需要量筒;
裝置D中發生氣體反應,裝置內壓強降低,裝置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
故答案為:量筒;防止D瓶溶液倒吸到B瓶中;
(2)裝置B中制備得到ClO2,裝置D反應后的溶液獲得NaClO2晶體,裝置D中生成NaClO2,Cl元素的化合價降低,雙氧水應表現還原性,有氧氣生成,結合原子守恒可知,還有水生成,配平后方程式為:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
B制得的氣體中含有SO2,在裝置D中被氧化生成硫酸,溶液中可能存在SO42-,用氯化鋇溶液檢驗SO42-,具體操作:取少量反應后的溶液,先加足量的鹽酸,再加BaCl2溶液,若產生白色沉淀,則說明含有SO42-,B中可能發生Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O,產生的SO2 被帶入D中,SO2與H2O2 反應生成硫酸鈉,濃硫酸難揮發,硫酸鈉是難揮發的鹽,不會進入D,故a正確,b、c錯誤,
故選:a,
故答案為:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;SO42-;取少量反應后的溶液,先加足量的鹽酸,再加BaCl2溶液,若產生白色沉淀,則說明含有SO42-;a;
(3)從溶液中制取晶體,一般采用蒸發結晶、過濾、洗滌、干燥的方法,為防止析出晶體NaClO2•3H2O,應趁熱過濾,由題目信息可知,應控制溫度38℃~60℃進行洗滌,低于60℃干燥,
故答案為:用38℃~60℃熱水洗滌;低于60℃干燥;
(4)由題目信息可知,應控制溫度38℃~60℃,高于60℃時NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能導致產品中混有的雜質是NaClO3和NaCl,
故答案為:NaClO3和NaCl;
(5)①碘遇淀粉變藍色,反應結束時,碘反應完全,滴加最后一滴Na2S2O3標準液時溶液藍色恰好褪去且半分鐘內不復原,說明到達滴定終點,
故答案為:滴加最后一滴Na2S2O3標準液時,溶液藍色恰好褪去且半分鐘內不復原,說明到達滴定終點;
②令樣品中NaClO2的物質的量x,則:
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L
故x=c•V•10-3mol
故答案為:c•V•10-3mol.
點評 本題考查亞氯酸鈉制備實驗的基本操作、亞氯酸鈉的性質及中和滴定等知識,理解原理是解題的關鍵,同時考查學生分析問題、解決問題的能力,題目難度中等.


科目:高中化學 來源: 題型:解答題
 如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
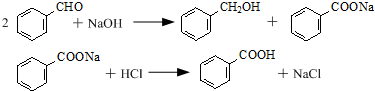
| 名稱 | 相對密度 | 熔點(℃) | 沸點(℃) | 溶解度 | |
| 水 | 乙醚 | ||||
| 苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
| 苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
| 苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
| 乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | -- |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 N2+4NH3;為抑制肼的分解,可采取的合理措施有降低反應溫度(任寫一種).
N2+4NH3;為抑制肼的分解,可采取的合理措施有降低反應溫度(任寫一種).
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AlCl3溶液與燒堿溶液反應,當n(OH-):n(Al3+)=7:2時,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液與NaHS溶液反應,當n(CuCl2):n(NaHS)=1:2時,Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2與FeBr2溶液反應,當n(Cl2):n(FeBr2)=1:1時,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Fe與稀硝酸反應,當n(Fe):n(HNO3)=1:2時,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com