
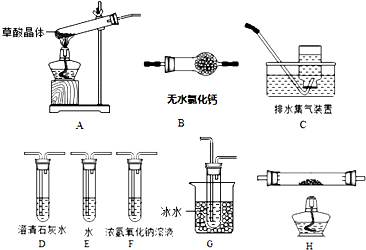
分析 (1)草酸晶體(H2C2O4•2H2O)無色,熔點為101℃,易溶于水,受熱脫水、升華,170℃以上分解,如果草酸受熱分解,分解時會產生二氧化碳而使澄清石灰水變渾濁;草酸的鈉鹽和鉀鹽易溶于水,而其鈣鹽難溶于水,G裝置溫度較低,有冷凝作用,防止干擾實驗;
(2)①要檢驗生成CO,在甲組實驗后,用濃氫氧化鈉除去二氧化碳,用澄清石灰水檢驗二氧化碳,用堿石灰干燥CO,利用CO的還原性將CO氧化,再利用澄清石灰水檢驗生成的二氧化碳,用排水法收集CO;H裝置中盛放的物質應該具有氧化性,且和CO反應有明顯現象發生;
②CO具有還原性,其氧化產物是二氧化碳,二氧化碳能使澄清石灰水變渾濁;
(3)由K可知酸性強弱,發生強酸制取弱酸的反應.
解答 解:(1)草酸晶體(H2C2O4•2H2O)無色,熔點為101℃,易溶于水,受熱脫水、升華,170℃以上分解,如果草酸受熱分解,分解時會產生二氧化碳,二氧化碳和氫氧化鈣反應生成難溶性的碳酸鈣沉淀而使澄清石灰水變渾濁,所以C中觀察到的現象是:有氣泡冒出且澄清石灰水變渾濁,說明有二氧化碳生成,則證明草酸晶體的分解產物中含有CO2,選用的裝置有AGDC;
草酸的鈉鹽和鉀鹽易溶于水,而其鈣鹽難溶于水,草酸易揮發,導致生成的氣體中含有草酸,草酸和氫氧化鈣反應生成難溶性的草酸鈣而干擾二氧化碳的檢驗,G裝置溫度較低,有冷凝作用,防止干擾二氧化碳的檢驗,
故答案為:AGDC;D有氣泡冒出,澄清石灰水變渾濁;冷凝(水蒸氣和草酸),防止草酸進入裝置C反應生成沉淀而干擾CO2的檢驗;
(2)①要檢驗生成CO,在甲組實驗后,用濃氫氧化鈉除去二氧化碳,用澄清石灰水檢驗二氧化碳,用堿石灰干燥CO,利用CO和CuO發生還原反應生成CO2,再利用澄清石灰水檢驗生成的二氧化碳,用排水法收集CO避免環境污染,所以其連接順序是A、F、D、B、H、D、C;
H裝置中盛放的物質應該具有氧化性,且和CO反應有明顯現象發生,CuO能被CO還原且反應過程中黑色固體變為紅色,現象明顯,所以H中盛放的物質是CuO,
故答案為:A、F、D、B、H、D、C;CuO;
②CO具有還原性,其氧化產物是二氧化碳,二氧化碳能使澄清石灰水變渾濁,且CO將黑色的CuO還原為紅色的Cu,只要H中黑色固體轉化為紅色且其后的D裝置溶液變渾濁就說明含有CO,
故答案為:H中黑色粉末變為紅色,其后的D中澄清石灰水變渾濁;
(3)由K可知酸性強弱,則Na2CO3溶液中滴加少量草酸溶液的離子方程式為2CO32-+H2C2O4=C2O42-+2HCO3-,故答案為:2CO32-+H2C2O4=C2O42-+2HCO3-.
點評 本題考查物質制備實驗和性質實驗方案設計,為高頻考點,側重考查學生知識綜合應用、實驗基本操作能力及實驗方案設計能力,綜合性較強,難點是排列實驗先后順序,根據實驗目的及物質的性質進行排列順序,注意要排除其它因素干擾,題目難度較大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過濾操作時,為了過濾效果好,要用玻璃棒攪拌 | |
| B. | 蒸餾操作時,應使溫度計水銀球靠近蒸餾燒瓶的支管口處 | |
| C. | 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出 | |
| D. | 蒸發操作時,為了防止局部過熱,要用玻璃棒攪拌 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2是堿性氧化物 | |
| B. | Na2O2中陰陽離子個數比為1:1 | |
| C. | 可用澄清石灰水來區分Na2CO3 和NaHCO3 | |
| D. | 與同濃度鹽酸反應的劇烈程度:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 微粒 | EO2- | EO3- |
| 立體構型名稱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com