
分析 Ⅰ、(1)已知K2S在反應中失去電子硫元素化合價升高,則該反應的氧化劑為濃硫酸,硫元素化合價降低;
(2)已知0.5molK2S在反應中失去1mol電子生成X,濃硫酸被還原為二氧化硫,結合電子守恒計算分析硫元素化合價;
(3)計算得到K2S被氧化為S,濃硫酸被還原為SO2,電子轉移依據元素化合價變化計算得到2e-;
(4)若反應中濃H2SO4過量產物中無S生成,說明硫化鉀被氧化為二氧化硫;
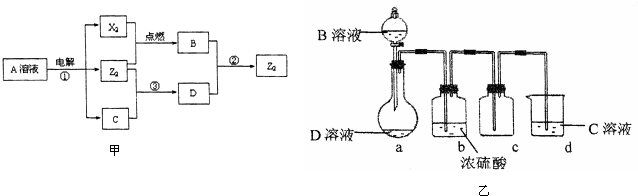
Ⅱ、短周期元素X、Y、Z的原子序數依次增大,Y與Z能形成離子個數比為1:1的離子化合物A,電解A溶液可得X2、Z2單質及C,有三種物質生成,其中兩種單質,為雙原子分子,應為電解水與電解質型的電解,則A為鹽溶液,該鹽溶液鹽的陽離子不能放電,酸根離子放電,則A可能為NaCl,則Y為鈉元素,Z為氯元素;X和Y同主族,且X的原子序數較小,X與Z能形成原子個數比為1:1的共價化合物,則X為氫元素.
若A為NaCl,電解NaCl溶液可得H2、Cl2單質及NaOH,H2與Cl2反應生成HCl,即B為HCl,氯氣能與氫氧化鈉反應生成次氯酸鈉,則X2 為H2,Z2為Cl2,次氯酸鈉能與HCl反應生成氯氣,故符合題意.
所以X為氫元素,Y為鈉元素,Z為氯元素;X2 為H2,Z2為Cl2,B為HCl,C為NaOH,D為NaClO;
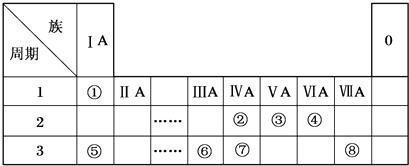
(1)Y為Na元素,在第三周期,第IA族;Z2為Cl2,各原子為8電子結構,原子間含有一個共用電子對;
(2)電解氯化鈉溶液生成H2、Cl2及NaOH;
(3)D溶液呈堿性的原因是次氯酸根離子水解生成次氯酸和氫氧根離子,溶液顯堿性;
(4)反應②是鹽酸與次氯酸鈉反應;
(5)沒有除去氯氣中的氯化氫;
解答 解:Ⅰ、(1)反應物與生成物有:濃H2SO4、K2S、K2SO4、SO2、H2O和一種未知物質X,已知K2S在反應中失去電子硫元素化合價升高,則該反應的氧化劑為濃硫酸,硫元素化合價降低,
故答案為:濃硫酸;
(2)已知0.5molK2S在反應中失去1mol電子生成X硫元素化合價為x,濃硫酸被還原為二氧化硫,結合電子守恒計算分析硫元素化合價,[x-(-2)]×0.5mol=1,x=0,則生成的X為S,
故答案為:S;
(3)計算得到K2S被氧化為S,濃硫酸被還原為SO2,電子轉移依據元素化合價變化和電子守恒計算得到2e-,則氧化劑為濃硫酸和還原劑為K2S,配平后系數填入空格中,標出電子轉移的方向和數目為: ,
,
故答案為: ;
;
(4)若反應中濃H2SO4過量產物中無S生成,同種元素不同價態間發生氧化還原反應最大程度發生歸中反應,說明硫化鉀被氧化為二氧化硫,反應的化學方程式為:4H2SO4(濃)+K2S=K2SO4+4SO2↑+4H2O,
故答案為:4H2SO4(濃)+K2S=K2SO4+4SO2↑+4H2O;
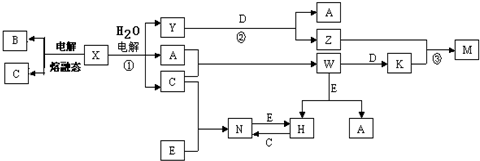
Ⅱ、短周期元素X、Y、Z的原子序數依次增大,Y與Z能形成離子個數比為1:1的離子化合物A,電解A溶液可得X2、Z2單質及C,有三種物質生成,其中兩種單質,為雙原子分子,應為電解水與電解質型的電解,則A為鹽溶液,該鹽溶液鹽的陽離子不能放電,酸根離子放電,則A可能為NaCl,則Y為鈉元素,Z為氯元素;X和Y同主族,且X的原子序數較小,X與Z能形成原子個數比為1:1的共價化合物,則X為氫元素.
若A為NaCl,電解NaCl溶液可得H2、Cl2單質及NaOH,H2與Cl2反應生成HCl,即B為HCl,氯氣能與氫氧化鈉反應生成次氯酸鈉,則X2 為H2,Z2為Cl2,次氯酸鈉能與HCl反應生成氯氣.故符合題意.
所以X為氫元素,Y為鈉元素,Z為氯元素;X2 為H2,Z2為Cl2,B為HCl,C為NaOH,D為NaClO.
(1)Y為Na元素,原子核外有3個電子層,最外層有1個電子,處于周期表第三周期第IA族,
故答案為:第三周期第IA族;
(2)反應①為電解氯化鈉溶液,生成氫氣、氯氣與氫氧化鈉,反應的化學方程式是2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案為:2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)D溶液呈堿性的原因是次氯酸根離子水解生成次氯酸和氫氧根離子,溶液顯堿性,反應的離子方程式為:ClO-+H2O?HClO+OH-;
故答案為:ClO-+H2O?HClO+OH-;
(4)反應②是鹽酸與次氯酸鈉反應,生成氯化鈉、氯氣與水,反應的離子方程式為ClO-+Cl-+2H+=Cl2↑+H2O,
故答案為:ClO-+Cl-+2H+=Cl2↑+H2O;
(5)由于鹽酸具有揮發性,上述實驗裝置制取的氯氣中含有氯化氫,應在a、b裝置之間加一盛有飽和食鹽水的洗氣瓶,除去HCl,
故答案為:在a、b裝置之間加一盛有飽和食鹽水(或水)的洗氣瓶,除去HCl;
點評 本題考查了物質性質的分析,氧化還原反應電子轉移、產物分析判斷,離子方程式書寫方法,實驗基本操作,掌握基礎是關鍵,題目難度中等.


 小天才課時作業系列答案
小天才課時作業系列答案 一課四練系列答案
一課四練系列答案 黃岡小狀元滿分沖刺微測驗系列答案
黃岡小狀元滿分沖刺微測驗系列答案 新輔教導學系列答案
新輔教導學系列答案 陽光同學一線名師全優好卷系列答案
陽光同學一線名師全優好卷系列答案科目:高中化學 來源: 題型:解答題
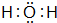 ,B的化學式NH3,C的離子符號NH4+
,B的化學式NH3,C的離子符號NH4+查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物只能由金屬元素和非金屬元素組成 | |
| B. | 離子化合物只能存在離子鍵 | |
| C. | HCl能電離出氫離子和氯離子,所以HCl存在離子鍵 | |
| D. | 共價化合物中不可能存在離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用托盤天平稱量時,應將NaOH固體放在小燒杯或玻璃器皿中 | |
| B. | 將燒杯中未冷卻的NaOH溶液直接注入未經干燥的容量瓶中 | |
| C. | 定容時視線應平視凹液面(或平視刻度線),直到凹液面的最低點與刻度線相切 | |
| D. | 將稱好的NaOH固體放入燒杯中,加入適量水溶解 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 阿司匹林(又稱乙酰水楊酸,
阿司匹林(又稱乙酰水楊酸, 是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128-135℃.某學習小組在實駐室以水楊酸(鄰羥基苯甲酸)與乙酸酐[(CH3CO)2O]為主要原料合成阿司匹林,其制備原理為:
是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128-135℃.某學習小組在實駐室以水楊酸(鄰羥基苯甲酸)與乙酸酐[(CH3CO)2O]為主要原料合成阿司匹林,其制備原理為: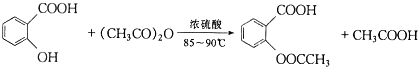
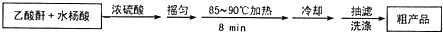

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
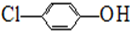 ),其原理如圖1所示.
),其原理如圖1所示.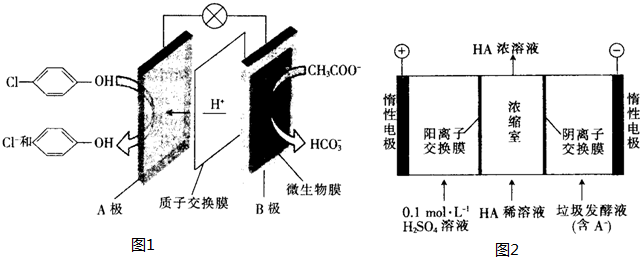
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com