
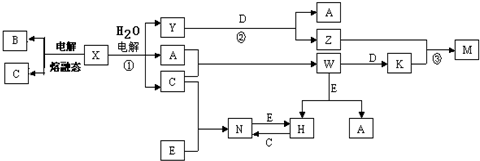
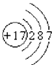 .
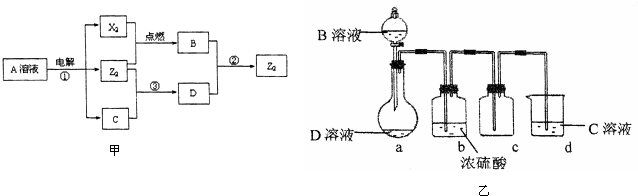
.分析 A、B、C、D、E是單質,X、Y、Z、M、N、W、H、K是化合物,B是短周期中原子半徑最大的元素的單質,則B為Na;電解熔融X得到Na,則X為NaCl,C為Cl2,電解NaCl溶液得到Y、A、C,則A為H2、Y為NaOH,單質D與氫氧化鈉反應得到氫氣與Z,故D為Al、J為NaAlO2,A與C反應生成W為HCl,W與D反應生成K為AlCl3,Z與K反應生成M為Al(OH)3,E為應用廣泛的金屬單質,與HCl反應生成H,H能與氯氣反應生成N,N與E反應由得到H,則E為變價金屬,故E為Fe、H為FeCl2、N為FeCl3,據此解答.
解答 解:A、B、C、D、E是單質,X、Y、Z、M、N、W、H、K是化合物,B是短周期中原子半徑最大的元素的單質,則B為Na;電解熔融X得到Na,則X為NaCl,C為Cl2,電解NaCl溶液得到Y、A、C,則A為H2、Y為NaOH,單質D與氫氧化鈉反應得到氫氣與Z,故D為Al、J為NaAlO2,A與C反應生成W為HCl,W與D反應生成K為AlCl3,Z與K反應生成M為Al(OH)3,E為應用廣泛的金屬單質,與HCl反應生成H,H能與氯氣反應生成N,N與E反應由得到H,則E為變價金屬,故E為Fe、H為FeCl2、N為FeCl3,
(1)C為Cl2,組成C的元素的原子結構示意圖是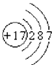 ,故答案為:
,故答案為: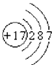 ;
;
(2)B為Na,在氧氣中燃燒生成的產物為Na2O2,Na2O2與H2O反應的化學方程式:2Na2O2+2H2O═4NaOH+O2↑,
故答案為:2Na2O2+2H2O═4NaOH+O2↑;
(3)用惰性電極電解NaCl的水溶液的陰極反應方程式:2H++2e-=H2↑,
故答案為:2H++2e-=H2↑;
(4)實驗室制備Al(OH)3的化學方程式:AlCl3+3NH3•H2O=Al(OH)3↓+3 NH4Cl,
故答案為:AlCl3+3NH3•H2O=Al(OH)3↓+3 NH4Cl.
點評 本題考查無機物推斷,涉及Na、Cl、Fe、Al元素化合物性質與轉化及電解原理等,以B的原子半徑為突破口進行推斷,需要學生熟練掌握元素化合物知識,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 “鹽水動力”玩具車的電池以鎂片、活性炭為電極,向極板上滴加食鹽水后電池便可工作,電池反應為2Mg+O2+2H2O=2Mg(OH)2.下列關于該電池的說法錯誤的是( )
“鹽水動力”玩具車的電池以鎂片、活性炭為電極,向極板上滴加食鹽水后電池便可工作,電池反應為2Mg+O2+2H2O=2Mg(OH)2.下列關于該電池的說法錯誤的是( )| A. | 鎂片作為正極 | |
| B. | 食鹽水作為電解質溶液 | |
| C. | 電池工作時鎂片逐漸被消耗 | |
| D. | 電池工作時實現了化學能向電能的轉化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲同學的方案可行 | |
| B. | 乙同學的方案可行 | |
| C. | 甲、乙兩位同學的方案都有局限性 | |
| D. | 甲、乙兩位同學的實驗所涉及的鹵代烴的性質一樣 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 工業上用電解熔融的氯化物的方法制備金屬鎂和鋁 | |
| B. | 適當提高合成氨原料氣中N2的含量,可提高H2的轉化率 | |
| C. | 從安全運輸上看,硫酸廠靠近硫酸消費中心比靠近原料產地更為有利 | |
| D. | 利用反應NaCl(飽和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3時,應在NaCl飽和溶液中先通入過量CO2再通入過量的NH3 | |
| E. | 硫酸廠生產時常采有高壓條件提高SO2的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 采用加熱分解法冶煉金屬鉀 | B. | 采用電解法冶煉金屬鋁和鈉 | ||
| C. | 采用熱還原法冶煉金屬鐵與汞 | D. | 采用熱還原法冶煉金屬銅與鈣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 有A、B、C、D、E、F六種常見物質,將它們分別溶于水,所得溶液顏色各不相同.已知:
有A、B、C、D、E、F六種常見物質,將它們分別溶于水,所得溶液顏色各不相同.已知:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com