



分析 (1)純水中c(H3O+)=c(OH-),K2=$\frac{c({H}_{3}{O}^{+}).c({O}^{2-})}{c(O{H}^{-})}$,則c(O2-)=$\frac{{K}_{2}.c(O{H}^{-})}{c({H}_{3}{O}^{+})}$=K2;
(2)催化劑在反應前后催化劑的質量、化學性質均不變,碘受熱易升華;
(3)帶結晶水的硝酸鐵、硝酸銅溶于水,然后向溶液中加入KOH并調節溶液的pH=4,生成Fe(OH)3、Cu(OH)2沉淀,過濾將沉淀洗滌、干燥然后煅燒得到CuFe2O4;
①硝酸鐵在水溶液中發生微弱水解生成氫氧化鐵;
②依據溶度積常數計算氫氧化鐵、氫氧化銅沉淀完全的溶液pH;
③流程中是過濾得到的濾渣經過洗滌干燥進行灼燒;
④氧缺位體與水反應生成氫和鐵酸銅(CuFe2O4),依據原子守恒書寫配平;
⑤將鐵酸銅樣品在N2的氣氛中充分煅燒,得氧缺位體的質量為原質量的96.6%,CuFe2O4-a的質量為CuFe2O4的96.6%,據此列式計算.
解答 解:(1)水中c(H3O+)=c(OH-),K2=$\frac{c({H}_{3}{O}^{+}).c({O}^{2-})}{c(O{H}^{-})}$,c(O2-)=$\frac{{K}_{2}.c(O{H}^{-})}{c({H}_{3}{O}^{+})}$=K2=1.0×10-36mol•L-1,故答案為:1.0×10-36;
(2)少量鋁粉和碘反應后生成物只有碘化鋁,說明水沒有參加反應,但是沒有加入水之前,鋁粉和碘沒有什么變化,加入水之后,反應放出的熱量使碘升華成紫色碘蒸氣,碘受熱易升華,說明反應是放熱反應,反應后生成物只有碘化鋁白色固體,說明水改變了該反應的速率,則水是一種催化劑;
故選C、D;
(3)①攪拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2,鐵離子水解生成氫氧化鐵,所以鐵元素的存在形式為Fe3+和Fe(OH)3,
故答案為:Fe(OH)3;
②攪拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2的物質的量濃度分別為2.6mol•L-1、1.3mol•L-1,沉淀完全的離子濃度小于10-5mol/L
已知:Ksp[Fe(OH)3]=2.6×10-39,c(OH-)=$\root{3}{\frac{2.6×1{0}^{-39}}{1{0}^{-5}}}$=6.4×10-12mol/L,c(H+)=1.6×10-3mol/L,PH=3-lg1.6≈2.8,圖象中鐵離子沉淀完全的pH錯誤;
Ksp[Cu(OH)2]=2.2×10-20,溶液中氫氧根離子濃度c(OH-)=$\sqrt{\frac{2.2×1{0}^{-20}}{1{0}^{-5}}}$=4.7×10-8mol/L,c(H+)=$\frac{1{0}^{-14}}{4.7×1{0}^{-8}}$=2.1×10-7mol/L,溶液的pH≈6.7,圖象B符合,
故答案為:B;
③流程中是過濾得到的濾渣經過洗滌干燥進行灼燒,操作Ⅲ為洗滌、干燥,
故答案為:洗滌;干燥;
④氧缺位體與水反應制氫的化學方程式為CuFe2O4-a+aH2O=CuFe2O4+aH2↑,
故答案為:CuFe2O4-a+aH2O=CuFe2O4+aH2↑;
⑤將鐵酸銅樣品在N2的氣氛中充分煅燒,得氧缺位體的質量為原質量的96.6%,CuFe2O4-a的質量為CuFe2O4的96.6%,則$\frac{M(CuF{e}_{2}{O}_{4-a})}{M(CuF{e}_{2}{O}_{4})}$×100%=96.6%,
解得:a=0.51,
故答案為:0.51.
點評 本題考查較為綜合,涉及物質分離提純的方法分析、溶度積常數的計算分析判斷、弱電解質電離分析應用,題目難度中等,注意反應過程中原子守恒的理解應用,掌握基礎是關鍵,試題培養了學生的分析、理解能力及靈活應用能力.


 奪冠金卷全能練考系列答案
奪冠金卷全能練考系列答案科目:高中化學 來源: 題型:選擇題
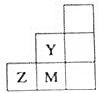
| A. | 非金屬性:Y>Z>M | |
| B. | 離子半徑:M->Z2->Y- | |
| C. | Z元素存在同素異形現象 | |
| D. | 三種元素中,Y的最高價氧化物對應的水化物酸性最強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
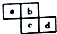
| A. | 原子半徑:c>d>a>b | |
| B. | 原子序數d可能是a的3倍 | |
| C. | 最高價含氧酸的酸性c可能比d強 | |
| D. | 四種元素的氫化物可能是18電子分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
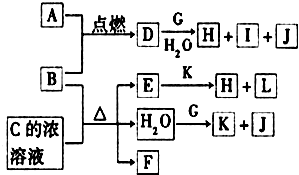 圖中,A~L為常見物質或該物質的水溶液,B在A氣體中燃燒產生棕黃色煙,B、G為中學化學中常見的金屬單質,E的稀溶液為藍色,I的焰色反應為黃色,組成J的元素原子核內只有一個質子,F為無色、有刺激性氣味的氣體,且能使品紅溶液褪色.
圖中,A~L為常見物質或該物質的水溶液,B在A氣體中燃燒產生棕黃色煙,B、G為中學化學中常見的金屬單質,E的稀溶液為藍色,I的焰色反應為黃色,組成J的元素原子核內只有一個質子,F為無色、有刺激性氣味的氣體,且能使品紅溶液褪色.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com