
分析 (1)X、Y和Z均為短周期元素,原子序數依次增大,X的單質為密度最小的氣體,為H元素;Y原子最外層電子數是其周期數的3倍,最外層電子數不超過8個,Z與X原子最外層電子數相同,則Z和X同一主族,則Z是Na元素,Y是O元素;
(2)由Y和Z的兩種單質可生成的一種淡黃色的固體化合物甲是過氧化鈉;鈉和氧氣在加熱條件下反應生成過氧化鈉;
(3)X2為氣體,是氫氣,氧氣與碳可形成一種還原性氣體乙為CO,當H2和氣體CO的混合物共1.6g與足量的O2充分反應后,在15℃通入20.0gNa2O2中充分反應后,分別生成NaOH、Na2CO3,水蒸氣和過氧化鈉反應生成NaOH后固體質量增加量相當于m(H2),二氧化碳和過氧化鈉反應生成生成碳酸鈉固體質量增加量相當于m(CO);
(4)與Y同族且處于第四周期的元素是Se元素,其原子序數=8+8+18.
解答 解:(1)X、Y和Z均為短周期元素,原子序數依次增大,X的單質為密度最小的氣體,為H元素;Y原子最外層電子數是其周期數的3倍,最外層電子數不超過8個,Z與X原子最外層電子數相同,則Z和X同一主族,則Z是Na元素,Y是O元素,
故答案為:H;O;Na;
(2)由Y和Z的兩種單質可生成的一種淡黃色的固體化合物甲是過氧化鈉,化學式為Na2O2;鈉和氧氣在加熱條件下反應生成過氧化鈉:反應方程式為2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
故答案為:Na2O2;2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
(3)X2為氣體,是氫氣,氧氣與碳可形成一種還原性氣體乙為CO,當H2和氣體CO的混合物共1.6g與足量的O2充分反應后,在15℃通入20.0gNa2O2中充分反應后,分別生成NaOH、Na2CO3,水蒸氣和過氧化鈉反應生成NaOH后固體質量增加量相當于m(H2),二氧化碳和過氧化鈉反應生成生成碳酸鈉固體質量增加量相當于m(CO),所以反應后固體增加的質量等于氫氣和CO的質量,為1.6g,最后固體質量為21.6g,最后的反應方程式分別為2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2═2Na2CO3+O2,
故答案為:21.6;2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2═2Na2CO3+O2;
(4)與Y同族且處于第四周期的元素是Se元素,其原子序數=8+8+18=34,
故答案為:34.
點評 本題考查原子結構和元素周期律的關系,為高頻考點,側重考查學生分析推斷及對元素化合物知識的綜合運用,明確原子結構、物質性質是解本題關鍵,注意同一主族元素原子序數計算方法,為易錯點.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
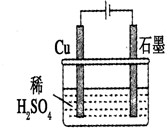
| A. | 石墨是電解池的負極,Cu是電解池的正極 | |
| B. | 電解過程中,銅電極上自身沒什么變化 | |
| C. | 電解一定時間后,石墨電極上會有銅析出 | |
| D. | 整個電解過程中,溶液的pH不會變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合粉末中物質的量之間一定滿足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物質的量之間一定滿足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物質的量之間一定滿足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,則20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題



查看答案和解析>>
科目:高中化學 來源: 題型:解答題
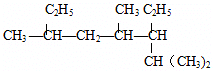 名稱:2,4,6-三甲基-3-乙基辛烷
名稱:2,4,6-三甲基-3-乙基辛烷 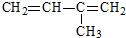 名稱:2-甲基-1,3-丁二烯
名稱:2-甲基-1,3-丁二烯
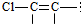 結構的有4種
結構的有4種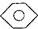 和
和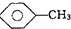 :KMnO4(H+)溶液.
:KMnO4(H+)溶液.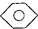 ,
,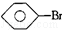 和C6H12(已烯):溴水.
和C6H12(已烯):溴水.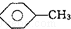 ,CCl4和乙醇:水.
,CCl4和乙醇:水.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 氫氧化物 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 由于工業發展,燃燒設備不斷增多,設備規模不斷增大.這些工廠排放的煙氣中都會有大量的SO2廢氣.據統計,我國1995年工業SO2的排放量為1396萬噸,2006年工業SO2的排放量達到了3800萬噸,由于SO2的污染,我國每年損失高達1100億元.
由于工業發展,燃燒設備不斷增多,設備規模不斷增大.這些工廠排放的煙氣中都會有大量的SO2廢氣.據統計,我國1995年工業SO2的排放量為1396萬噸,2006年工業SO2的排放量達到了3800萬噸,由于SO2的污染,我國每年損失高達1100億元.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com