
| A. | 混合粉末中物質的量之間一定滿足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物質的量之間一定滿足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物質的量之間一定滿足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,則20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
分析 向反應后的溶液中滴入KSCN溶液,溶液不顯紅色,說明溶液中沒有Fe3+,且進入amL硫酸后混合粉末完全溶解,同時還生成bL(標準狀況)H2,發生的反應有:
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O①
Cu+Fe2O3+3H2SO4=2FeSO4+CuSO4+3H2O②
Fe+H2SO4=FeSO4+H2↑③,
根據方程式①②③得n(Fe)+n(Cu)=n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$;
如果a=72.50、b=1.12,
硫酸中的H+完全反應后生成H2和H2O,根據H原子守恒得n(H2SO4)=n(H2)+n(H2O),則n(H2O)=4.00mol/L×0.0725L-$\frac{1.12L}{22.4L/mol}$=0.29mol-0.05mol=0.24mol,
根據O原子守恒計算n(Fe2O3);
根據轉移電子守恒及Cu、Fe的質量計算n(Fe)、n(Cu).
解答 解:向反應后的溶液中滴入KSCN溶液,溶液不顯紅色,說明溶液中沒有Fe3+,且進入amL硫酸后混合粉末完全溶解,同時還生成bL(標準狀況)H2,發生的反應有:
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O①
Cu+Fe2O3+3H2SO4=2FeSO4+CuSO4+3H2O②
Fe+H2SO4=FeSO4+H2↑③,
根據方程式①②③得n(Fe)+n(Cu)=n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$;
如果a=72.50、b=1.12,
硫酸中的H+完全反應后生成H2和H2O,根據H原子守恒得n(H2SO4)=n(H2)+n(H2O),則n(H2O)=4.00mol/L×0.0725L-$\frac{1.12L}{22.4L/mol}$=0.29mol-0.05mol=0.24mol,
根據O原子守恒得n(Fe2O3)=$\frac{1}{3}$n(H2O)=$\frac{1}{3}$×0.24mol=0.08mol;
則m(Fe)+m(Cu)=20.40g-160g×0.08=7.6g,
設n(Fe)=xmol、n(Cu)=ymol,結合轉移電子守恒得
$\left\{\begin{array}{l}{56x+64y=7.6}\\{2x+2y=0.08×2×1+0.05×2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.09}\\{y=0.04}\end{array}\right.$,
即n(Fe)=0.09mol、n(Cu)=0.04mol、n(Fe2O3)=0.08mol,
通過以上分析知,只有C正確;
故選C.
點評 本題考查混合物的有關計算,側重考查學生分析計算及知識綜合運用能力,明確溶液中溶質成分及物質之間發生的反應是解本題關鍵,注意反應過程中原子守恒及轉移電子守恒的靈活運用,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 開始滴入NaOH溶液時立即產生白色沉淀 | |
| B. | 原固體混合物中鎂的質量是1.2g | |
| C. | V=100mL | |
| D. | 若將5.1g該合金溶于足量的氫氧化鈉溶液,在常溫常壓下放出3.36L氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4g D2和足量O2反應可生成D2O 2NA個 | |
| B. | 98g H3PO4和H2SO4的混合物中含氫原子2.5NA個 | |
| C. | 6.02×1023個葡萄糖分子約含羥基6NA個 | |
| D. | 1molNa完全燃燒可轉移電子NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6g、0.1mol | B. | 4.6g、0.2mol | C. | 0.3g、0.2mol | D. | 5.0g、0.4mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

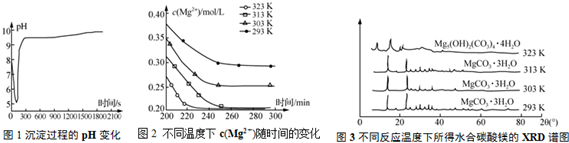
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
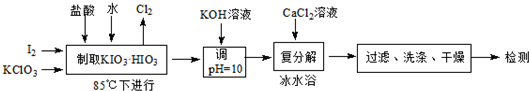
| 溫度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸鈣存在形態 | 無水鹽 | 一水合物 | 六水合物 |
| 穩定時的溫度區域 | >57.5℃ | 32-57.5℃ | <32℃ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com