

分析 從弱堿性鹵水(主要成分為MgCl2)中獲取MgCO3•3H2O,在鹵水中加氫氧化鈉并通入二氧化碳得碳酸鎂晶體沉淀,經洗滌、烘干、得MgCO3•3H2O,
(1)沉淀過程中生成MgCO3•3H2O↓,根據電荷守恒和元素守恒書寫反應的離子方程式;
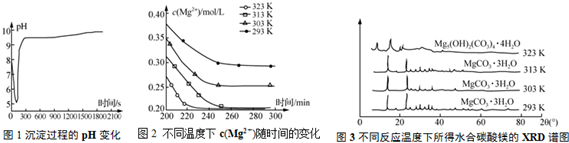
(2)根據圖1可知,沉淀過程的pH隨時間的變化是先變小后增大,然后保持在9-10之間左右,而溶液起始的PH值在7-8左右,據此判斷;
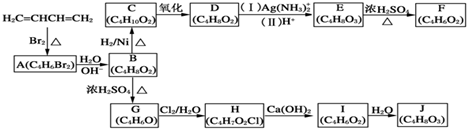
(3)根據圖2可知,較高的溫度能夠加快沉淀反應的速率,也使得溶液中殘留的c(Mg2+)較小,根據圖3可知,323K時,Mg2+生成Mg5(OH)2(CO3)4•4H2O沉淀;
(4)MgCO3•3H2O在323K溫度時轉化成Mg5(OH)2(CO3)4•4H2O,根據元素守恒書寫化學方程式;
(5)在洗滌步驟中,沉淀是從含有氯離子的溶液中析出的,所以可以通過檢驗氯離子判斷產物洗滌是否干凈.
解答 解:從弱堿性鹵水(主要成分為MgCl2)中獲取MgCO3•3H2O,在鹵水中加氫氧化鈉并通入二氧化碳得碳酸鎂晶體沉淀,經洗滌、烘干、得MgCO3•3H2O,
(1)沉淀過程中生成MgCO3•3H2O↓,反應的離子方程式為Mg2++CO2+2OH-+2H2O═MgCO3•3H2O↓,
故答案為:Mg2++CO2+2OH-+2H2O═MgCO3•3H2O↓;
(2)根據圖1可知,沉淀過程的pH隨時間的變化是先變小后增大,然后保持在9-10之間左右,而溶液起始的PH值在7-8左右,所以沉淀過程的操作為向鹵水中通入CO2至飽和,然后滴加NaOH溶液,同時繼續通入CO2,故選c;
(3)根據圖2可知,較高的溫度能夠加快沉淀反應的速率,也使得溶液中殘留的c(Mg2+)較小,根據圖3可知,323K時,Mg2+生成Mg5(OH)2(CO3)4•4H2O沉淀,所以選擇的溫度為313K,理由是較高的溫度能夠加快沉淀反應的速率,也使得溶液中殘留的c(Mg2+)較小,提高Mg2+的沉淀率,但溫度過高易生成Mg5(OH)2(CO3)4•4H2O,
故答案為:313K;較高的溫度能夠加快沉淀反應的速率,也使得溶液中殘留的c(Mg2+)較小,提高Mg2+的沉淀率,但溫度過高易生成Mg5(OH)2(CO3)4•4H2O;
(4)MgCO3•3H2O在323K溫度時轉化成Mg5(OH)2(CO3)4•4H2O,反應的化學方程式為5MgCO3•3H2O$\frac{\underline{\;加熱\;}}{\;}$Mg5(OH)2(CO3)4•4H2O+CO2↑+10H2O,
故答案為:5MgCO3•3H2O$\frac{\underline{\;加熱\;}}{\;}$Mg5(OH)2(CO3)4•4H2O+CO2↑+10H2O;
(5)在洗滌步驟中,沉淀是從含有氯離子的溶液中析出的,所以可以通過檢驗氯離子判斷產物洗滌是否干凈,所以表明產物洗滌干凈的操作為取最后一次洗滌濾液,向其中加入HNO3酸化的AgNO3溶液,若無白色沉淀生成,則已洗滌干凈,
故答案為:取最后一次洗滌濾液,向其中加入HNO3酸化的AgNO3溶液,若無白色沉淀生成,則已洗滌干凈.
點評 本題考查制備實驗方案的設計,為高考考點,準確理解工業原理、掌握實驗基本操作為解答的關鍵,側重分析與實驗能力的考查,題目難度不大.


 智能訓練練測考系列答案
智能訓練練測考系列答案 計算高手系列答案
計算高手系列答案科目:高中化學 來源: 題型:解答題
 +H2O,
+H2O,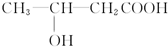 和
和 以外,還有
以外,還有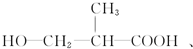 、
、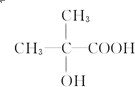 (寫出結構簡式,不考慮立體異構).
(寫出結構簡式,不考慮立體異構). ;
;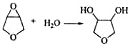 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合粉末中物質的量之間一定滿足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物質的量之間一定滿足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物質的量之間一定滿足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,則20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
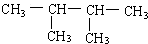 系統命名:2,3-二甲基丁烷
系統命名:2,3-二甲基丁烷
 的分子式:C4H8O
的分子式:C4H8O查看答案和解析>>
科目:高中化學 來源: 題型:解答題
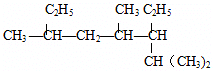 名稱:2,4,6-三甲基-3-乙基辛烷
名稱:2,4,6-三甲基-3-乙基辛烷 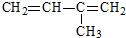 名稱:2-甲基-1,3-丁二烯
名稱:2-甲基-1,3-丁二烯
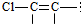 結構的有4種
結構的有4種 和
和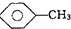 :KMnO4(H+)溶液.
:KMnO4(H+)溶液.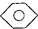 ,
,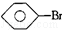 和C6H12(已烯):溴水.
和C6H12(已烯):溴水.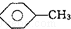 ,CCl4和乙醇:水.
,CCl4和乙醇:水.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com