
| 陽離子 | Fe3+ | Fe2+ | Cu2+ |
| 開始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
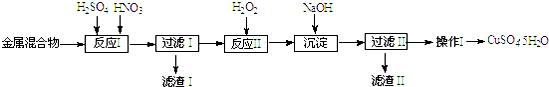
分析 含Cu、Fe及少量Au、Pt等金屬的混合物加入硫酸和硝酸溶解銅和鐵,金和鉑不溶解,過濾得到濾渣為Au、Pt,濾液中加入過氧化氫氧化亞鐵離子為鐵離子,加入氫氧化鈉溶液調節溶液的PH在3.2--4.2范圍內,沉淀鐵離子,過濾得到濾渣Ⅱ為氫氧化鐵,濾液為硫酸銅溶液,通過加熱濃縮、冷卻結晶、過濾、洗滌、干燥得到膽礬晶體,
(1)金屬的混合物中加入硫酸和硝酸,Cu、Fe會發生反應變為溶液,Au、Pt難溶解;
(2)反應Ⅱ中加入H2O2的作用是將溶液中Fe2+氧化為Fe3+,便于將雜質Fe元素除去;
(3)生成沉淀反應是鐵離子生成氫氧化鐵沉淀;
(4)操作Ⅰ是從溶液中得到溶質晶體,具體的步驟是加熱濃縮、冷卻結晶、過濾、洗滌、干燥;
(5)2CuSO4•5H2O~2Cu2+~2Iˉ~I2~2S2O32-,n(S2O32-)=0.1mol/L×0.012L×10=0.012mol,計算得到硫酸銅晶體物質的量,計算得到樣品中膽礬晶體的質量分數.
解答 解:(1)含Cu、Fe及少量Au、Pt等金屬的混合物中加入硫酸和硝酸Cu、Fe會發生反應變為溶液,Au、Pt難溶解,所以濾渣Ⅰ的主要成份是Au、Pt,
故答案為:Au、Pt;
(2)反應Ⅱ中加入H2O2的作用是將溶液中Fe2+氧化為Fe3+,2Fe2++H2O2+2H+=2Fe3++2H2O,通過調節溶液PH便于將雜質Fe元素除去,
故答案為:使Fe2+氧化為Fe3+;
(3)生成沉淀反應的離子方程式有:Fe3++3OHˉ=Fe(OH)3↓,
故答案為:Fe3++3OHˉ=Fe(OH)3↓;
(4)操作Ⅰ是硫酸銅溶液中得到硫酸銅晶體,操作的步驟是加熱濃縮、冷卻結晶、過濾、洗滌、干燥,故答案為:加熱濃縮、冷卻結晶;
(5)2Cu2++4Iˉ=2CuI↓+I2,I2+2S2O32-=2Iˉ+S4O62-,
2CuSO4•5H2O~2Cu2+~2Iˉ~I2~2S2O32-,
n(S2O32-)=0.1mol/L×0.012L×10=0.012mol,
所以n(CuSO4•5H2O)=0.012mol,
其質量是0.012mol×250g/mol=3.0g,
所以樣品中膽礬晶體的質量分數是$\frac{3.0g}{3.125g}$×100%=96%,
故答案為:96%;
點評 本題考查元素及化合物的性質、雜質的除去、離子方程式的書寫、關系式法在化學計算中的應用及物質純度的計算的知識,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 1 mol H2SO4的質量是98 g/mol | |
| B. | CO2的摩爾質量等于CO2的相對分子質量 | |
| C. | 摩爾質量建立了物質的物質的量與物質的質量之間的聯系 | |
| D. | 1 mol任何物質的質量等于該物質的相對分子質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 測定次數 | 待測液體積/mL | 標準鹽酸體積/mL | |
| 滴定前讀數/mL | 滴定后讀數/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 現使用酸堿中和滴定法測定市售白醋的總酸量(g•100mL-1).
現使用酸堿中和滴定法測定市售白醋的總酸量(g•100mL-1).| 滴定次數實驗數據(mL) | 1 | 2 | 3 | 4 |
| V(樣品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.
Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
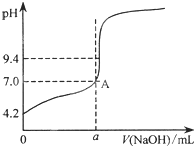 現用鄰苯二甲酸氫鉀標準溶液來測定NaOH溶液的濃度.用氫氧化鈉溶液來滴定鄰苯二甲酸溶液時有下列操作:
現用鄰苯二甲酸氫鉀標準溶液來測定NaOH溶液的濃度.用氫氧化鈉溶液來滴定鄰苯二甲酸溶液時有下列操作:| 滴定次數 實驗數據 | 1 | 2 | 3 | 4 |
| V(樣品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初讀數) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(終讀數) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
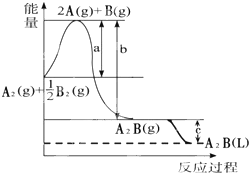 已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反應過程中能量變化如圖,問:
已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反應過程中能量變化如圖,問:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com