
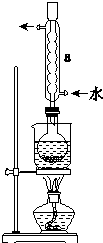
 Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.
Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.分析 (1)根據儀器結構特征寫出其名稱,冷凝管起到冷凝回流的作用;
(2)由于Na2S2O3、Na2SO3具有還原性,易被氧氣氧化Na2SO4,檢驗溶液是否硫酸根離子進行判斷;
(3)S2O32-與氫離子在溶液中能夠發生氧化還原反應生成硫單質與二氧化硫;
(4)滴定前溶液為無色,滴定結束后,碘單質使淀粉變藍;
(5)根據圖示的滴定管中液面讀出初讀數、終讀數,然后計算出消耗碘的標準溶液體積;根據反應2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后根據題中碘單質的物質的量計算出Na2S2O3•5H2O質量及產品的純度;
(6)根據題干信息“Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-”及化合價升降相等寫出反應的離子方程式.
解答 解:(1)根據圖示中儀器的結構特征,可知儀器a為冷凝管,該實驗中冷凝管具有冷凝回流的作用,
故答案為:冷凝管;冷凝回流;
(2)由于Na2S2O3、Na2SO3具有還原性,易被氧氣氧化Na2SO4,所以可能存在的雜質是Na2SO4;檢驗硫酸鈉的方法為:取少量產品溶于過量稀鹽酸,過濾,向濾液中加BaCl2溶液,若有白色沉淀,則產品中含有Na2SO4,
故答案為:Na2SO4; 取少量產品溶于過量稀鹽酸,過濾,向濾液中加BaCl2溶液,若有白色沉淀,則產品中含有Na2SO4;
(3)S2O32?與氫離子發生氧化還原反應生成淡黃色硫單質,反應的離子方程式為:S2O32?+2H+=S↓+SO2↑+H2O,
故答案為:S2O32?+2H+=S↓+SO2↑+H2O;
(4)滴定結束后,碘單質使淀粉變藍,所以滴定終點時溶液顏色變化為:由無色變為藍色,
故答案為:由無色變為藍色;
(5)根據反應2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以W g產品中含有Na2S2O3•5H2O質量為:0.1000 mol•L-1×18.10×10-3L×2×M=3.620×10-3Mg,則產品的純度為:$\frac{3.620×1{0}^{-3}Mg}{Wg}$×100%=$\frac{3.620×1{0}^{-3}Mg}{Wg}$×100%,
故答案為:$\frac{3.620×1{0}^{-3}Mg}{Wg}$×100%;
(6)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,根據化合價升降相等配平后的離子方程式為:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+,
故答案為:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
點評 本題考查了化學實驗基本操作方法及常見儀器的構造、離子的檢驗方法、中和滴定存在即計算、離子方程式的書寫等知識,題目難度較大,試題涉及的題量較大,知識點較多,充分考查了學生對所學知識的掌握情況.


 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 與硫酸產生氫氣多 | B. | 與氫氧化鈉溶液產生氫氣多 | ||
| C. | 兩者產生氫氣一樣多 | D. | 無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Cu(OH)2 | Fe(OH)3 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
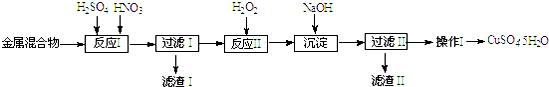
| 陽離子 | Fe3+ | Fe2+ | Cu2+ |
| 開始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
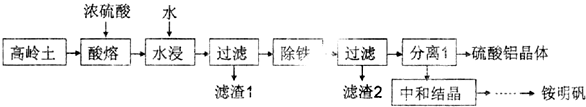
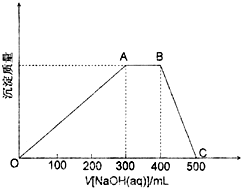
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com