
分析 (1)根據準確配制一定體積一定物質的量濃的溶液用到的儀器來回答;
(2)殘缺方程式配平首先確定缺什么,根據電子轉移守恒,配平化學方程式;
(3)酸式滴定管可以量取具有強氧化性的溶液,高錳酸鉀具有顏色,錳離子無色;
(4)根據化學方程式計算消耗過氧化氫的量然后計算質量分數;
(5)若滴定前滴定管尖嘴中有氣泡,滴定后氣泡消失,則消耗的標準溶液的體積偏大.
解答 解:(1)準確配制一定體積一定物質的量濃的溶液用容量瓶;
故答案為:容量瓶;
(2)方程式中,高錳酸鉀有強氧化性,能將雙氧水氧化為氧氣,先確定缺的是O2,錳元素化合價降低了5價,生成1mol氧氣時,氧元素化合價升高2價,根據電子轉移守恒,配平化學方程式高錳酸根前面的系數為2,雙氧水前面的系數為5,根據原子守恒來配平其他物質前面的系數,離子方程式2MnO4-+5H2O2+6H+=2Mn2++8H2O+502↑,
故答案為:2、5、6、2、8、5O2;
(3)由于高錳酸鉀標準溶液具有強氧化性,所以只能使用酸式滴定管,滴定到達終點的現象是:滴入一滴高錳酸鉀溶液,溶液呈淺紅色,且30秒內不褪色,
故答案為:酸式;滴入一滴高錳酸鉀溶液,溶液呈淺紅色,且30秒內不褪色;
(4)根據化學方程式可以得到關系式:2MnO4-~5H2O2,耗用c mol/L KMnO4標準溶液V mL,即cV×10-3mol的高錳酸鉀時,所用雙氧水的物質的量:2.5cV×10-3mol,則原過氧化氫的質量為:0.025cVmol×34g/mol=0.85cV,過氧化氫溶液中過氧化氫的質量分數為:$\frac{0.85cV}{10.00mL×ρg/mL}$=$\frac{0.085cV}{ρ}$,
故答案為:$\frac{0.085cV}{ρ}$;
(5)若滴定前滴定管尖嘴中有氣泡,滴定后氣泡消失,則消耗的標準溶液的體積偏大,所以計算的KMnO4的物質的量偏大,則過氧化氫的物質的量偏大,所以測得結果偏高;
故答案為:偏高.
點評 本題是一道綜合知識題目,涉及儀器的選擇、離子方程式的配平、滴定終點的確定、質量分數的計算,要求學生具有分析和解決問題的能力,注意把握中和滴定實驗原理和操作方法,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | △H>0、△S<0 | B. | △H>0、△S>0 | C. | △H<0、△S<0 | D. | △H<0、△S>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
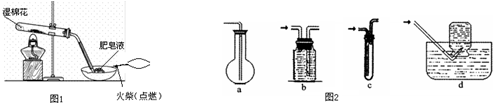
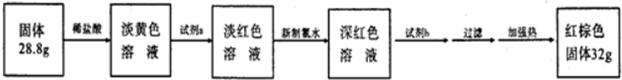
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測液體積/mL | 標準鹽酸體積/mL | |
| 滴定前讀數 | 滴定后讀數 | ||
| 第1次 | 20.00 | 4.10 | 29.10 |
| 第2次 | 20.00 | 0.00 | 24.90 |
| 第3次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
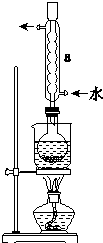 Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.
Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定 次數 | 待測溶液的體積(mL) | 0.100 0mol•L-1NaOH的體積(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積(mL) | ||
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
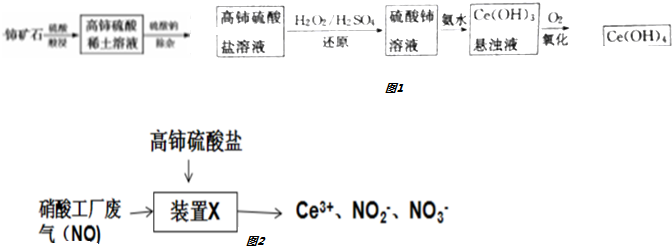
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com