

分析 軟錳礦:MnO2含量≥65%;Al2O3含量為4%.閃鋅礦:ZnS含量≥80%;FeS、CuS、CdS含量各為2%,軟錳礦、閃鋅礦與硫酸溶液共熱時可析出硫,濾液A為硫酸鐵、硫酸錳、硫酸鋁、硫酸銅、硫酸鎘的水溶液,加入適量金屬鋅,鋅和鐵離子反應生成鋅離子和亞鐵離子,鋅和銅離子反應生成銅和鋅離子,濾液B中含金屬離子:Zn2+、Mn2+、Fe2+、Al3+,過濾得到濾渣為銅、鎘,濾液B中加入二氧化錳氧化亞鐵離子為鐵離子,加入化合物C后可得純凈的ZnSO4、MnSO4溶液,C可以是ZnO或Zn(OH)2,Mn(OH)2、MnCO3或ZnCO3,電解ZnSO4、MnSO4溶液得到鋅、二氧化錳和D為硫酸,
(1)MnO2和FeS在酸溶液中發生氧化還原反應生成硫單質、硫酸錳、硫酸鐵和水,結合電荷守恒和原子守恒配平書寫離子方程式;
(2)代替二氧化錳氧化亞鐵離子不能引入難易除去的雜質;
(3)加入化合物C后可得純凈的ZnSO4,MnSO4溶液,C可以是鋅錳的氧化物、氫氧化物、碳酸鹽,目的是調節溶液PH除去鐵離子,得到溶液,通過電解ZnSO4、MnSO4溶液得到鋅、二氧化錳和D為硫酸;
(4)電解過程中MnO2應在陽極生成,因Mn元素失去電子;
(5)①將制得的MnO2(s)與KOH(s),KClO3(s)按比例混合,加熱熔融(不斷攪拌)可得KCl和K2MnO4的固體混合物,結合氧化還原反應電子守恒和原子守恒配平書寫化學方程式得到物質的量之比;
②向綠色溶液中通入適量CO2后,將溶液加熱,并趁熱濾去殘渣含MnO2(s)將濾液蒸發濃縮、冷卻結晶、過濾、洗滌、干燥得紫色KMnO4晶體 生成產物為二氧化錳、高錳酸鉀和碳酸鉀;
③二氧化碳過量會生成溶解度小的碳酸氫鉀隨高錳酸鉀晶體析出混入雜質.
解答 解:軟錳礦:MnO2含量≥65%;Al2O3含量為4%.閃鋅礦:ZnS含量≥80%;FeS、CuS、CdS含量各為2%,軟錳礦、閃鋅礦與硫酸溶液共熱時可析出硫,濾液A為硫酸鐵、硫酸錳、硫酸鋁、硫酸銅、硫酸鎘的水溶液,加入適量金屬鋅,鋅和鐵離子反應生成鋅離子和亞鐵離子,鋅和銅離子反應生成銅和鋅離子,濾液B中含金屬離子:Zn2+、Mn2+、Fe2+、Al3+,過濾得到濾渣為銅、鎘,濾液B中加入二氧化錳氧化亞鐵離子為鐵離子,加入化合物C后可得純凈的ZnSO4、MnSO4溶液,C可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,電解ZnSO4、MnSO4溶液得到鋅、二氧化錳和D為硫酸,
(1)MnO2和FeS在酸溶液中發生氧化還原反應生成硫單質、硫酸錳、硫酸鐵和水,結合電荷守恒和原子守恒配平書寫離子方程式為:3MnO2+2FeS+12H+$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3++3Mn2++2S+6H2O,
故答案為:3MnO2+2FeS+12H+$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3++3Mn2++2S+6H2O;
(2)代替二氧化錳氧化亞鐵離子不能引入難易除去的雜質,
A.KMnO4固體會氧化亞鐵離子,但會引入鉀離子,故A不符合;
B.H2O2 可以氧化亞鐵離子,且不引入新的雜質,故B符合;
C.濃硝酸會氧化亞鐵離子,但會引入硝酸根離子,故C不符合;
D.濃硫酸具有強氧化性,不因人員新的雜質,故D符合
E.新制氯水可以氧化亞鐵離子,但會引入氯離子,故D不符合;
故答案為:BD;
(3)加入化合物X后可得純凈的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2,MnCO3或ZnCO3,硫酸根離子不變,且生成氫離子,可知產品D的化學式為H2SO4,該物質對整個生產的意義是用于溶解軟錳礦和閃鋅礦,循環使用,
故答案為:MnCO3或ZnCO3;H2SO4;
(4)因Mn元素失去電子,可知步驟④中電解過程中MnO2在陽極析出,該電極上發生的反應方程式為Mn2+-2e-+2H2O=MnO2+4H+,
故答案為:Mn2+-2e-+2H2O=MnO2+4H+;
(5)①將制得的MnO2(s)與KOH(s),KClO3(s)按比例混合,加熱熔融(不斷攪拌)可得KCl和K2MnO4的固體混合物,錳元素化合價+4價變化為+6價,電子轉移2e-,
氯元素化合價+5價變化為-1價,電子轉移6e-,電子轉移總數為6e-,配平的化學方程式為:3MnO2(s)+6KOH(s)+KClO3(s)=KCl+3K2MnO4+3H2O,為了使MnO2,KOH,KC1O3恰好完全反應,三者的物質的量之比應為3:6:1,
故答案為:3:6:1;
②向綠色溶液中通入適量CO2后,將溶液加熱,并趁熱濾去殘渣含MnO2(s)將濾液蒸發濃縮、冷卻結晶、過濾、洗滌、干燥得紫色KMnO4晶體 生成產物為二氧化錳、高錳酸鉀和碳酸鉀,反應的化學方程式為:2CO2+3K2MnO4$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+MnO2↓+2K2CO3,
故答案為:2CO2+3K2MnO4$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+MnO2↓+2K2CO3;
③二氧化碳過量會生成溶解度小的碳酸氫鉀隨高錳酸鉀晶體析出混入雜質,③Ⅲ中需控制CO2的用量,若CO2過量,會使所得產品的純度降低,原因可能是通入過量CO2會生成溶解度小的KHCO3,隨KMnO4晶體一起析出,
故答案為:通入過量CO2會生成溶解度小的KHCO3,隨KMnO4晶體一起析出.
點評 本題考了物質分離提純的實驗過程分析,主要是離子性質、離子分離、離子檢驗、電解池原理和電極反應書寫,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 20.0g | B. | 19.2g | C. | 40.0g | D. | 80.0g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | Cu(OH)2 | Fe(OH)3 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
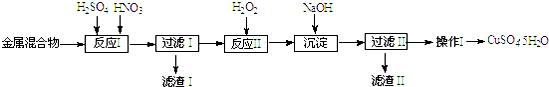
| 陽離子 | Fe3+ | Fe2+ | Cu2+ |
| 開始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
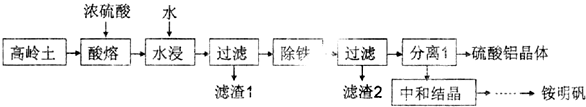
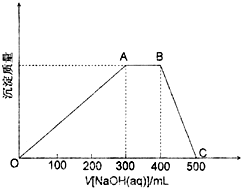
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 對叔丁基苯酚(
對叔丁基苯酚(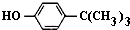 )工業用途廣泛,可用于生產油溶性酚醛樹脂、穩定劑和香料等.實驗室以苯酚、叔丁基氯[(CH3)3CCl]等為原料制備對叔丁基苯酚.實驗步驟如下:
)工業用途廣泛,可用于生產油溶性酚醛樹脂、穩定劑和香料等.實驗室以苯酚、叔丁基氯[(CH3)3CCl]等為原料制備對叔丁基苯酚.實驗步驟如下: .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 名稱 | 相對分 子質量 | 性狀 | 密度(g/mL) | 沸點(℃) | 溶解性 | |
| 苯胺 | 93 | 無色油狀液體 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 無色液體 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶體 | 1.22 | 304 | 微溶于冷水,可溶于熱水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用惰性電極電解NaH2PO2溶液,其陰極反應式為:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2與過量NaOH溶液反應的離子方程式為:H3PO2+3OH-═PO23-+3H2O | |
| C. | 將H3PO2溶液加入到酸性重鉻酸鉀溶液中,H3PO2的還原產物可能為H3PO4 | |
| D. | H3PO2溶于水的電離方程式為H3PO2?H++H2PO2- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com