
分析 (1)鐵和氫氧化鈉不反應,鋁和氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,根據氫氣和鋁之間的關系式計算鋁的物質的量;
(2)該反應中稀硫酸作氧化劑,根據氫氣和轉移電子之間的關系式計算轉移電子的物質的量,相同質量的鋁與足量稀硫酸或氫氧化鈉反應生成的氫氣體積相同,再根據鐵和氫氣之間的關系式計算鐵的質量;
(3)經洗滌、干燥、灼燒后得到一種固體,經稱量發現該固體的質量和原混合物的質量恰好相等,則氧化鐵中氧元素的質量等于混合物中Al的質量,以此計算.
解答 解:(1)鐵和氫氧化鈉不反應,鋁和氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,離子反應方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,
設鋁的物質的量為x,
2Al+2OH-+2H2O=2AlO2-+3H2↑
2mol 67.2L
x nL
x=$\frac{2mol×nL}{67.2L}$=$\frac{5n}{168}$
混合物中Al的物質的量為$\frac{5n}{168}$,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;$\frac{5n}{168}$;
(2)該反應中轉移電子數等于氫離子得到的電子數=$\frac{m}{22.4}$×2=$\frac{5m}{56}$mol,相同質量的鋁與足量稀硫酸或氫氧化鈉反應生成的氫氣體積相同,所以等質量的鋁和稀硫酸反應生成氫氣的體積是nL,則鐵與稀硫酸反應生成氫氣的體積=(m-n)L,
設鐵的質量是y,
Fe+H2SO4=FeSO4+H2↑
56g 22.4L
y (m-n)L
y=$\frac{56g×(m-n)L}{22.4L}$=2.5(m-n)g,
即轉移電子的物質的量是$\frac{5m}{56}$,鐵的質量是2.5(m-n)g,
故答案為:$\frac{5m}{56}$;2.5(m-n)g;
(3)向(2)所得的溶液中加入過量的氫氧化鈉溶液,將產生的沉淀過濾出來,經洗滌、干燥、灼燒后得到一種固體,經稱量發現該固體的質量和原混合物的質量恰好相等,則氧化鐵中氧的質量等于原混合物中Al的質量,所以Al的質量分數為$\frac{16×3}{160}$×100%=30%,故答案為:30%.
點評 本題考查較綜合,涉及金屬的化學性質,離子方程式的書寫及計算、質量分數的計算等,注意鋁和氫氧化鈉溶液反應而Fe不能,側重學生計算能力的考查,題目難度中等,(3)中注意守恒法的應用為解答的關鍵.


科目:高中化學 來源: 題型:填空題
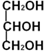 )與足量丙酸(CH3CH2COOH)發生酯化的反應方程式:
)與足量丙酸(CH3CH2COOH)發生酯化的反應方程式: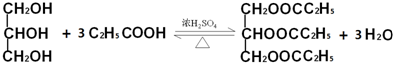
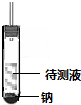 若有氣泡產生(且產生的氣體可燃)則其結構為CH3CH2OH;如無明顯現象,則為CH3OCH3.
若有氣泡產生(且產生的氣體可燃)則其結構為CH3CH2OH;如無明顯現象,則為CH3OCH3.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
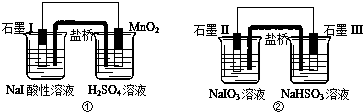
| A. | 兩個裝置中石墨I和石墨II作負極 | |
| B. | 碘元素在裝置①中被氧化,在裝置②中被還原 | |
| C. | ①中MnO2的電極反應式為:MnO2+2H2O+2e-═Mn2++4OH? | |
| D. | 反應①、②中生成等量的I2時導線上通過的電子數之比為1:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸氫銨溶液與足量的氫氧化鈉溶液反應:NH4++OH-=NH3•H2O | |
| B. | 鈉與水反應:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 銅和稀硝酸反應:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 氯化鋁溶液顯酸性:Al3++3H2O?Al(OH)3↓+3H + |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑤⑦ | B. | ①④⑥⑦ | C. | ①②③④⑥ | D. | ①③④⑤⑦ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com