
 某溶液只含有下列離子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四種(忽略水的電離),且各離子的物質的量濃度相等,現進行如下實驗:
某溶液只含有下列離子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四種(忽略水的電離),且各離子的物質的量濃度相等,現進行如下實驗:| A. | 由實驗①只能確定原溶液中一定有NH4+,沒有Fe2+. | |
| B. | 取實驗②后的溶液滴加淀粉溶液,可能變藍色. | |
| C. | 原溶液中可能含有NH4+、Na+、SO32-、I-四種離子 | |
| D. | 取少量原溶液加酸性高錳酸鉀溶液,可能有兩種離子被氧化 |
分析 ①取少量該溶液加NaOH溶液共熱,產生刺激性氣味的氣體即為NH3,即溶液中含NH4+,根據NH4+是弱堿陽離子,能和AlO2-發生雙水解來分析;未觀察到其它明顯現象,故溶液中無Fe2+;
②另取少量該溶液加足量的硝酸,可觀察到紅棕色氣體,說明溶液中有還原性離子,即I-、SO32-均有或至少有一種,據此分析.
解答 解:某溶液只含有下列離子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四種(忽略水的電離),且各離子的物質的量濃度相等.
①取少量該溶液加NaOH溶液共熱,產生刺激性氣味的氣體,即NH3,即溶液中含NH4+,根據NH4+是弱堿陽離子,能和AlO2-發生雙水解,故溶液中無AlO2-;未觀察到其它明顯現象,故溶液中無Fe2+;
②另取少量該溶液加足量的硝酸,可觀察到紅棕色氣體,說明溶液中有還原性離子,即I-、SO32-均有或至少有一種.
故溶液中一定無Fe2+、AlO2-;一定有NH4+,I-、SO32-均有或至少有一種,可能有Na+、NO3-.
由于離子要求有4種,且各離子的物質的量濃度相等,根據溶液要滿足電荷守恒可知,溶液中不能存在SO32-,當溶液中有SO32-時,則一定還含Na+、NH4+,不能含NO3-和I-,此時溶液中額離子種類不是4種,不符合題意要求;則溶液中一定含I-,根據要含4中離子且濃度相等,故溶液中一定含Na+、NH4+、I-、NO3-;
A、由實驗①除了能確定原溶液中一定有NH4+,沒有Fe2+,根據離子之間的互斥性,還能確定一定不含AlO2-,故A錯誤;
B、由于溶液中含I-,故加入足量的硝酸后能將其氧化為I2,故加入淀粉后變藍,故B正確;
C、根據溶液的電荷守恒可知,溶液中不能存在SO32-,故C錯誤;
D、由于溶液中含Na+、NH4+、I-、NO3-,故加入高錳酸鉀溶液后,只有I-被氧化,故D錯誤.
故選B.
點評 本題考查了離子的檢驗,根據離子共存在以及溶液的電中性來分析,綜合性較強,難度較大.


 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (A-x+m)mol | B. | (A-x-m)mol | C. | $\frac{W}{A}$(A-x+m)mol | D. | $\frac{W}{A}$(A-x-m)mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

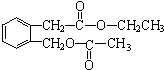 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$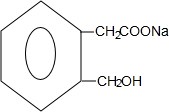 +CH3COONa+CH3CH2OH+H2O;反應類型是水解反應(或取代反應);
+CH3COONa+CH3CH2OH+H2O;反應類型是水解反應(或取代反應);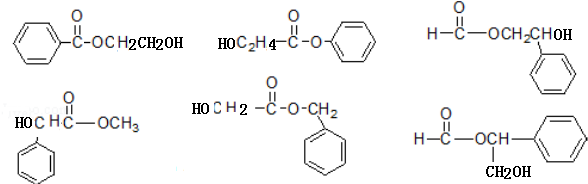 (任寫兩個).
(任寫兩個).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )的酸性廢水,可利用微生物電池法除去,其原理如圖2所示
)的酸性廢水,可利用微生物電池法除去,其原理如圖2所示查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com