
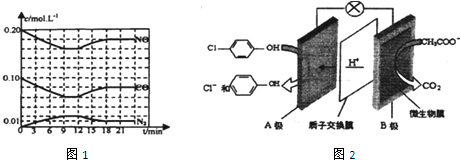
 )的酸性廢水,可利用微生物電池法除去,其原理如圖2所示
)的酸性廢水,可利用微生物電池法除去,其原理如圖2所示分析 Ⅰ.①依據圖象讀出平衡濃度,結合平衡常數概念計算平衡常數;
②12min后反應物濃度增大,生成物濃度減小,說明平衡逆向進行;
③根據濃度商和平衡常數比較判斷反應進行的方向;
①根據原電池中陽離子的移動方向確定正負極;
②B為負極,發生氧化反應;
③根據電極反應式結合電子得失守恒來計算氫離子的物質的量濃度,依據pH=-lg[H+]計算溶液pH值.
解答 解Ⅰ.①:依據圖象分析,第一次達到平衡時時平衡狀態下物質的濃度為c(NO)=0.16mol/L,c(CO)=0.06mol/L,c(N2)=0.02mol/L,c(CO2)=0.04mol/L,反應的平衡常數K=$\frac{c(N{\;}_{2})•c{\;}^{2}(CO{\;}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$
=$\frac{0.02×0.04×0.04}{0.16×0.16×0.06×0.06}$=0.347L•mol-1;
故答案為:0.347L•mol-1;
②12min后反應物濃度增大,生成物濃度減小,說明平衡逆向進行,反應是放熱反應,升溫改變符合圖象變化;
故答案為:升溫;因反應速率加快且反應逆向移動,對放熱反應而言,改變條件為升溫;
③24min時,各物質的濃度為c(NO)=0.18mol/L,c(CO)=0.08mol/L,c(N2)=0.01mol/L,c(CO2)=0.02mol/L,反應的平衡常數K=$\frac{0.01×0.0{2}^{2}}{0.18{\;}^{2}×0.0{8}^{2}}$=0.019,
若保持溫度不變,此時再向容器中充入CO、N2各0.060mol,c(NO)=0.18mol/L,c(CO)=0.14mol/L,c(N2)=0.07mol/L,c(CO2)=0.02mol/L,濃度商計算Qc=$\frac{0.07×0.0{2}^{2}}{0.1{8}^{2×}0.1{4}^{2}}$=0.044>K,平衡逆向進行,
故答案為:逆向;
Ⅱ①原電池中氫離子的移動方向是從負極流向正極,所以A是電池的正極,
故答案為:正;
②B為負極,發生氧化反應,電極方程式為CH3COO--8e-+2H2O=2CO2+7H+;
故答案為:CH3COO--8e-+2H2O=2CO2+7H+;
③B為負極,發生氧化反應,依據電極方程式CH3COO--8e-+2H2O=2CO2+7H+得:
CH3COONa~8e-
82 8
2.05g 0.2mol
A是正極,正極上發生得電子的還原反應:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,
-OH+Cl-,
則:
Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,
-OH+Cl-,
2 1
0.2mol 0.1mol
所以A極區氫離子的物質的量濃度為$\frac{0.1mol}{1L}$=0.1mol/L,溶液pH=-lg[H+]=1,
故答案為:1.
點評 本題為綜合題,考查了化學平衡常數的計算及應用、影響化學平衡移動的因素、原電池工作原理,題目難度中等,注意原電池的計算依據正極得到電子數目等于負極失去電子數目.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
 某溶液只含有下列離子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四種(忽略水的電離),且各離子的物質的量濃度相等,現進行如下實驗:
某溶液只含有下列離子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四種(忽略水的電離),且各離子的物質的量濃度相等,現進行如下實驗:| A. | 由實驗①只能確定原溶液中一定有NH4+,沒有Fe2+. | |
| B. | 取實驗②后的溶液滴加淀粉溶液,可能變藍色. | |
| C. | 原溶液中可能含有NH4+、Na+、SO32-、I-四種離子 | |
| D. | 取少量原溶液加酸性高錳酸鉀溶液,可能有兩種離子被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
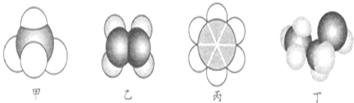
| A. | 22.4 L甲中含有10 mol電子 | |
| B. | 乙與乙的加聚產物都能使溴水褪色 | |
| C. | 丙不能與溴水、酸性高錳酸鉀溶液發生反應 | |
| D. | 丙、丁都可以萃取溴水中的溴單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p5 | D. | X:2s22p3 Y:1s1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 LSO3所含電子數約為40 NA | |
| B. | 0.5 mol NH4HSO4晶體中,含有H+數目約為0.5 NA | |
| C. | 92 g NO2、N2O4混合氣體含有的N原子數為2NA | |
| D. | 1 mol Cl2作為氧化劑得到的電子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 從KI和I2的固體混合物中回收I2,可使用如圖甲所示實驗裝置 | |
| B. | 分離Na2CO3溶液和CH3COOC2H5,可使用如圖乙所示實驗裝置 | |
| C. | 用圖丙所示儀器配制0.150mol/LNaOH溶液 | |
| D. | 如圖丁所示可用于實驗室制氨氣并收集干燥的氨氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性KI淀粉溶液在空氣中久置后變藍:4I-+O2+2H2O=2I2+4OH- | |
| B. | 用Na2CO3溶液處理水垢中的CaSO4:CO32-+CaSO4?CaCO3+SO42- | |
| C. | 鉛蓄電池充電時陰極質量減輕:PbSO4+2e-=Pb+SO42- | |
| D. | 明礬與足量Ba(OH)2溶液混合有沉淀出現:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com