
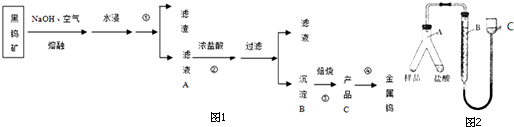
分析 黑鎢礦堿溶后,得到得到的濾液為鎢酸的鈉鹽,加入濃鹽酸,制取鎢酸;鎢酸(H2WO4)加熱分解產生三氧化鎢(WO3),判斷C為三氧化鎢(WO3);H2、CO等還原氧化鎢生成鎢;
(1)根據化合價升降分析氧化還原反應;
(2)操作①之后,分為濾渣和濾液,故為過濾;鎢酸鈉和濃鹽酸反應生成鎢酸(H2WO4)和氯化鈉;鎢酸(H2WO4)加熱分解產生三氧化鎢(WO3)和水,判斷C為三氧化鎢(WO3);H2、CO還原氧化鎢生成鎢;
(3)為測定其中金屬鎢的含量(已知金屬鎢不溶于鹽酸),首先檢驗檢查氣密性;然后加入稱量好的樣品和鹽酸;將A中鹽酸與樣品混合;待A中不再有氣體產生并恢復至室溫后,記錄B的液面位置;
(4)用排水法收集H2,排出水的體積等于H2的體積;根據關系式:Fe~H2,樣品中的鎢的質量分數的計算式為1-$\frac{56V}{22.4a}$;
(5)讀取圖2C裝置液面數據時,應先調整BC液面相平,再平視讀數;若樣品中含有不溶于酸,也不與酸反應的物質,把此雜質當做鎢,則測得鎢的質量分數將偏大.
解答 解:(1)①②屬于復分解反應,③是分解反應;④為WO3制取W,化合價反應發生變化,屬于氧化還原反應,故答案為:④;
(2)操作①之后,分為濾渣和濾液,故為過濾;鎢酸鈉和濃鹽酸反應生成鎢酸(H2WO4)和氯化鈉;方程式為Na2WO4+2HCl→H2WO4↓+2NaCl;鎢酸(H2WO4)酸性很弱,難溶于水,判斷B為鎢酸(H2WO4);鎢酸(H2WO4)加熱分解產生三氧化鎢(WO3)和水,判斷C為三氧化鎢(WO3);H2、CO還原氧化鎢生成鎢;
故答案為:過濾;Na2WO4+2HCl→H2WO4↓+2NaCl;WO3;H2或CO;
(3)為測定其中金屬鎢的含量(已知金屬鎢不溶于鹽酸),首先檢驗檢查氣密性;然后加入稱量好的樣品和鹽酸;將A中鹽酸與樣品混合;待A中不再有氣體產生并恢復至室溫后,記錄B的液面位置;
故答案為:②①④③;
(4)用排水法收集H2,測得排出水的體積為VL(標準狀況下),則H2的體積也為VL;Fe~H2,Fe的物質的量為$\frac{V}{22.4×3}$mol,樣品中的鎢的質量分數的計算式為1-$\frac{56V}{22.4a}$=$\frac{22.4a-56V}{22.4a}×100%$;
故答案為:V;$\frac{22.4a-56V}{22.4a}×100%$;
(5)讀取圖2C裝置液面數據時,應先調整BC液面相平,再平視讀數;若樣品中含有不溶于酸,也不與酸反應的物質,把此雜質當做鎢,則測得鎢的質量分數將偏大;
故答案為:調整BC液面相平;偏大.
點評 本題主要考查工業制備流程、金屬的冶煉和化學計算,題目難度不大,本題注意判斷A、B、C三種物質.


科目:高中化學 來源: 題型:選擇題
| A. | 按系統命名法,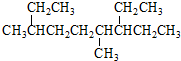 的名稱為3,6-二甲基-7-乙基壬烷 的名稱為3,6-二甲基-7-乙基壬烷 | |
| B. | 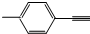 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 標準狀況下,1 L辛烷完全燃燒生成CO28L | |
| D. | 1.0 mol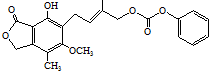 最多能與5.0 mol NaOH水溶液完全反應 最多能與5.0 mol NaOH水溶液完全反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用催化法處理尾氣中的CO和NO:CO+NO$\frac{\underline{\;催化劑\;}}{\;}$C+NO2 | |
| B. | 少量SO2通入到Ba(OH)2溶液:SO2+Ba2++2OH-═BaSO3↓+H2O | |
| C. | NH4HCO3溶于過量的NaOH溶液中:HCO3+OH-═CO32-+H2O | |
| D. | 濃鹽酸與二氧化錳供熱:Mn2O+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Q1=Q2=Q3=57.3 | B. | Q1>Q2>Q3>57.3 | C. | Q3<Q1<Q2=57.3 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
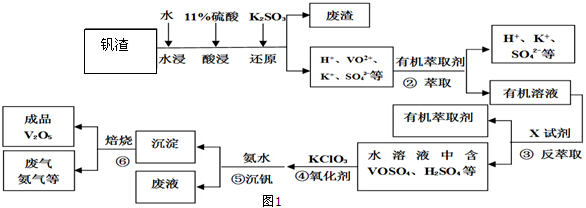
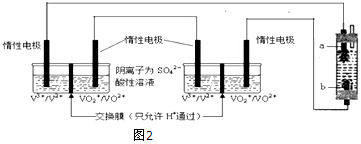
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
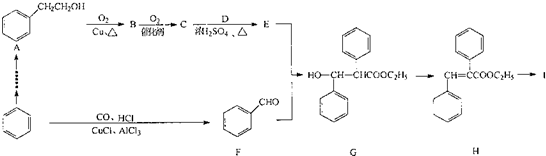
 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反應類型為加成反應.
+2H2O:E+F--G的反應類型為加成反應. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 簡單離子的半徑:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最簡單氣態氧化物的穩定性比C的強 | |
| C. | D2C2與A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高價氧化物對應的水化物中 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com