
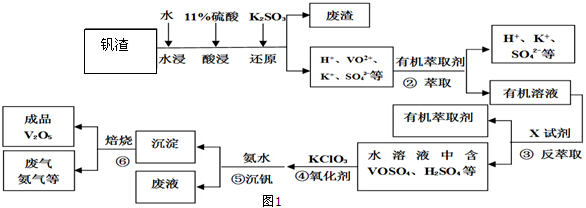
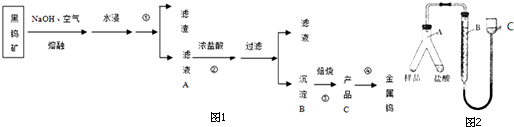
分析 釩渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入還原劑K2SO3,V2O5被還原為VO2+離子,加入有機萃取劑,通過萃取②,把剩余的酸和有機層分開,通過反萃取③,把萃取劑和離子分開,加入氧化劑氯酸鉀④,氯酸鉀把VO2+氧化成VO3+,離子方程式為:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,調節pH得到含釩的沉淀,焙燒得到V2O5和氨氣,有機萃取劑和氨氣再循環利用.
(1)根據化合價代數和為0確定化合價;廢釩催化劑的主要成分中二氧化硅不溶于酸;
(2)③中反萃取時加入的X試劑是抑制平衡正向進行;
(3)②中萃取時必須加入適量堿,分析平衡,R2(SO4)n(水層)+2nHA(有機層)?2RAn(有機層)+nH2SO4(水層),加入的堿會和平衡中的氫離子反應促進平衡正向進行;提高②中萃取效率還可多次連續萃取;
(4)用化合價升降法配平方程式;
(5)鋁熱反應實質是置換反應,鋁與五氧化二釩反應生成釩與氧化鋁;
(6)在電解池的陰極上是陽離子得電子發生還原反應,在陽極上是陰離子發生失電子的氧化反應;原電池的正極發生還原反應;氯氣可以和強堿反應生成氯化鈉、次氯酸鈉和水,根據得失電子守恒計算理論上最多能產生NaClO的質量.
解答 解:釩渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入還原劑K2SO3,V2O5被還原為VO2+離子,加入有機萃取劑,通過萃取②,把剩余的酸和有機層分開,通過反萃取③,把萃取劑和離子分開,加入氧化劑氯酸鉀④,氯酸鉀把VO2+氧化成VO3+,離子方程式為:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,調節pH得到含釩的沉淀,焙燒得到V2O5和氨氣,有機萃取劑和氨氣再循環利用.
(1)氮的化合價為-3價,氫得化合價為+1價,氧的化合價為-2價,設(NH4)2V6O16中釩中V元素的化合價為x,根據化合價代數和為0得:[-3+1×(+4)]×2+6x+(-2)×16=0,解得x=+5,二氧化硅不和硫酸反應,故廢渣中含二氧化硅,
故答案為:+5;SiO2;
(2)③中反萃取時加入的X試劑是抑制平衡正向進行,可以加入硫酸抑制平衡正向進行,故答案為:稀硫酸;
(3))②中萃取時必須加入適量堿,分析平衡,R2(SO4)n(水層)+2nHA(有機層)?2RAn(有機層)+nH2SO4(水層),即Rn+(水層)+nHA(有機層)?RAn(有機層)+nH+(水層),加入堿(具體堿均可)中和硫酸使平衡正移,提高②中萃取效率還可采取多次連續萃取,
故答案為:加入堿(具體堿均可)中和硫酸使平衡正移、多次連續萃取;
(4)氯元素化合價從+5→-1,化合價降低6,釩化合價從+4→+5,化合價升高1,二者最小公倍數為6,把變價元素配平,初步配平為:ClO3-+6VO2++H+→6VO3++Cl-+H2O,根據氧原子守恒確定H2O前系數為3,氫離子前系數為6,故配平后為:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,
故答案為:1;6;6;6;1;Cl-;3;H2O;
(5)鋁與五氧化二釩反應生成釩與氧化鋁,反應反應方程式為:10Al+3V2O5$\frac{\underline{\;高溫\;}}{\;}$6V+5Al2O3,故答案為:10Al+3V2O5$\frac{\underline{\;高溫\;}}{\;}$6V+5Al2O3,
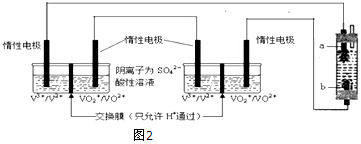
(6)將兩個全釩液流儲能電池串聯后作為電源,用石墨作電極電解飽和氯化鈉溶液,若通電時,為使生成的Cl2被完全吸收,制得有較強殺菌能力的消毒液,則電解池的下端產生的是氯氣,上端產生的是氫氣,電解池的陰極上是陽離子氫離子得電子發生得電子的還原反應,生成氫氣,在陽極上是陰離子氯離子發生失電子的氧化反應,生成氯氣,所以a是陰極,b是陽極生成Cl2,原電池的正極得到電子發生還原反應,全釩液流儲能電池正極的電極反應式為:VO2++e-+2H+=VO2++H2O,制取消毒液所涉及反應的化學方程式為:Cl2+2NaOH=NaCl+NaClO+H2O,每生成1molNaClO轉移1mol電子,若通過消毒液發生器的電子為0.2mol,理論上最多能產生NaClO的質量為0.2mol×74.5g/mol=14.9g,
故答案為:陽;VO2++e-+2H+=VO2++H2O;14.9.
點評 本題考查了流程分析判斷、物質性質和實驗設計的方法應用、題干信息分析判斷能力,側重考查物質的分離提純、電解反應、電極產物的分析應用、工藝流程的理解,掌握基礎是關鍵,題目難度中等.


 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案科目:高中化學 來源: 題型:解答題
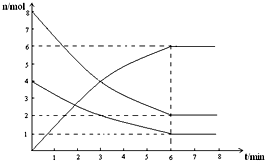 在673K、容積為2L的容器中發生下述反應,2SO2+O2?2SO3,開始時充入8molSO2和4molO2.測得各物質的物質的量隨時間的變化曲線如圖所示:
在673K、容積為2L的容器中發生下述反應,2SO2+O2?2SO3,開始時充入8molSO2和4molO2.測得各物質的物質的量隨時間的變化曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在粗鹽提純中,當加熱到蒸發皿中有較多固體析出,殘留少量液體時,停止加熱,用余熱將液體蒸干 | |
| B. | 當振蕩分液漏斗中的混合溶液時,須用一只手壓住分液漏斗的玻璃塞,另一只手握住旋塞,將分液漏斗倒轉過來,用力振蕩 | |
| C. | 從加碘鹽中獲取碘單質的操作步驟為:溶解-萃取-分液-蒸餾 | |
| D. | 實驗過程中若皮膚不慎沾上少量堿液,應先用大量水沖洗,再用2%醋酸溶液或飽和硼酸溶液洗,最后用水沖洗 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
濃度/mol•L-1 時間/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 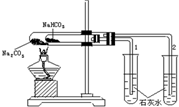 用如圖裝置比較Na2CO3與NaHCO3的穩定性 | |
| B. |  用如圖裝置吸收NH3,并防止倒吸 | |
| C. | 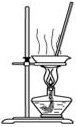 用如圖裝置蒸干AlCl3飽和溶液制備AlCl3晶體 | |
| D. | 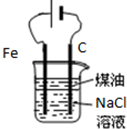 用如圖裝置制取Fe(OH)2沉淀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com