
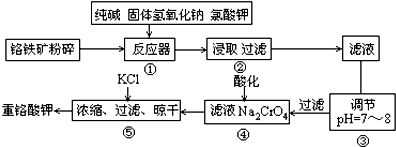
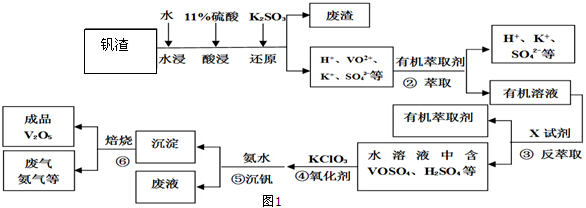
分析 將鉻酸礦粉碎目的是增大反應物接觸面積,加快反應速率,然后向反應器中加入純堿、NaOH、KClO3,發生反應6FeO•Cr2O3+24NaOH+7KClO3$\frac{\underline{\;\;△\;\;}}{\;}$12Na2CrO4+3Fe2O3+7KCl+12H2O、SiO2+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑、Al2O3+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$2NaAlO2+CO2↑、2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑、Fe2O3+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$2NaFeO2+CO2↑、SiO2+2NaOH=Na2SiO3+H2O、Al2O3+2NaOH=2NaAlO2+H2O,然后浸取,Na2CrO4、Na2SiO3、NaAlO2、KCl都易溶于水,Fe2O3難溶于水,NaFeO2在水溶液中發生水解生成Fe(OH)3,然后過濾,得到濾液中含有Na2CrO4、Na2SiO3、NaAlO2、KCl,調節溶液pH為7-8,由于硅酸鈉和偏鋁酸鈉在溶液中發生水解,離子方程式為SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反應方向移動,當pH調到7~8時能使它們完全水解生成沉淀H2SiO3、Al(OH)3,向濾液中加入酸進行酸化,離子方程式為2CrO42-+2H+?Cr2O72-+H2O,然后向溶液中加入KCl,進行濃縮、過濾、晾干得到K2Cr2O7,說明溶液中K2Cr2O7溶解度小于Na2Cr2O7,據此分析解答.
解答 解:將鉻酸礦粉碎目的是增大反應物接觸面積,加快反應速率,然后向反應器中加入純堿、NaOH、KClO3,發生反應6FeO•Cr2O3+24NaOH+7KClO3$\frac{\underline{\;\;△\;\;}}{\;}$12Na2CrO4+3Fe2O3+7KCl+12H2O、SiO2+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑、Al2O3+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$2NaAlO2+CO2↑、2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑、Fe2O3+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$2NaFeO2+CO2↑、SiO2+2NaOH=Na2SiO3+H2O、Al2O3+2NaOH=2NaAlO2+H2O,然后浸取,Na2CrO4、Na2SiO3、NaAlO2、KCl都易溶于水,Fe2O3難溶于水,NaFeO2在水溶液中發生水解生成Fe(OH)3,然后過濾,得到濾液中含有Na2CrO4、Na2SiO3、NaAlO2、KCl,調節溶液pH為7-8,由于硅酸鈉和偏鋁酸鈉在溶液中發生水解,離子方程式為SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反應方向移動,當pH調到7~8時能使它們完全水解生成沉淀H2SiO3、Al(OH)3,向濾液中加入酸進行酸化,離子方程式為2CrO42-+2H+?Cr2O72-+H2O,然后向溶液中加入KCl,進行濃縮、過濾、晾干得到K2Cr2O7,說明溶液中K2Cr2O7溶解度小于Na2Cr2O7,
(1)固體反應時接觸面積越大反應速率越快,所以堿浸前將鉻鐵礦粉碎的作用是增大接觸面積、加快反應速率,故答案為:增大接觸面積、加快反應速率;
(2)反應器①中除發生題中所給反應外,請寫出其它兩個化學方程式(要求兩個反應中反應物均不相同)為SiO2+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑、Al2O3+2NaOH=2NaAlO2+H2O或Al2O3+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$2NaAlO2+CO2↑、SiO2+2NaOH=Na2SiO3+H2O;
通過以上分析知,③中調節pH=7-8所得濾渣為H2SiO3、Al(OH)3,
故答案為:SiO2+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑(或Al2O3+2NaOH=2NaAlO2+H2O);Al2O3+Na2CO3$\frac{\underline{\;高溫\;}}{\;}$2NaAlO2+CO2↑(或SiO2+2NaOH=Na2SiO3+H2O);H2SiO3;Al(OH)3;
(3)④中離子方程式為2CrO42-+2H+?Cr2O72-+H2O,酸化時平衡向正反應方向移動,有利于生成Na2Cr2O7,故答案為:2CrO42-+2H+?Cr2O72-+H2O中增大氫離子濃度平衡向右移動;
(4)⑤加入KCl能得到K2Cr2O7晶體說明K2Cr2O7溶解度較小且受溫度影響較大,故答案為:K2Cr2O7溶解度較小且受溫度影響較大;
(5)①判斷達到滴定終點的依據是滴加最后一滴硫代硫酸鈉溶液,溶液藍色褪色,且振蕩后半分鐘內不恢復,故答案為:滴加最后一滴硫代硫酸鈉溶液,溶液藍色褪色,且振蕩后半分鐘內不恢復;
②反應Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反應的關系式為Cr2O72-~3I2~6S2O32-,設配制的25.00mL重鉻酸鉀溶液中重鉻酸鉀的物質的量為nmol,
Cr2O72-~3I2~6S2O32-
1 6
n 0.1200mol/L×0.04L
1:6=n:(0.1200mol/L×0.04L)
n=$\frac{0.1200mol/L×0.04L×1}{6}$=0.0008mol,
則250mL重鉻酸鉀溶液中重鉻酸鉀的物質的量為0.008mol,
重鉻酸鉀的純度=$\frac{0.008mol×294g/mol}{2.500g}×100%$=94%,
故答案為:94%.
點評 本題考查物質制備實驗方案設計,涉及物質分離和提純、物質純度的滴定實驗等知識點,綜合性較強,側重考查學生分析、計算能力,能從整體上把握分析發生的反應、實驗操作方法是解本題關鍵,知道每一步發生的反應及物質的性質,題目難度中等.


科目:高中化學 來源: 題型:解答題
 Cu3N具有良好的電學和光學性能,在電子工業領域、航空航天領域、國防領域、通訊領域以及光學工業等領域中,發揮著廣泛的、不可替代的巨大作用.
Cu3N具有良好的電學和光學性能,在電子工業領域、航空航天領域、國防領域、通訊領域以及光學工業等領域中,發揮著廣泛的、不可替代的巨大作用. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮與水的反應是氧化還原反應 | |
| C. | 二氧化氮不是造成大氣污染的氣體之一 | |
| D. | 在通常狀況下測得的NO2的相對分子質量是不準確的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Q1=Q2=Q3=57.3 | B. | Q1>Q2>Q3>57.3 | C. | Q3<Q1<Q2=57.3 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
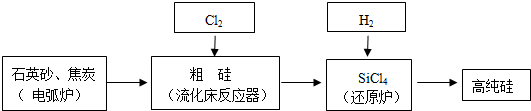
| 物質 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸點/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
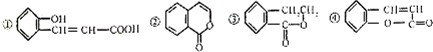
| A. | 只有①能和碳酸鈉反應放出氣體 | B. | ②和④互為同分異構體 | ||
| C. | ①②④都可以使溴水褪色 | D. | ④與H2加成后可以得到③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com