
| A. | 若1mL PH=1鹽酸與100mL MaOH溶液混合后,溶液PH=7,則NaOH溶液的PH=11 | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好無色,則此時溶液的PH<7 | |
| C. | 某醋酸溶液的PH=a,將此溶液稀釋1倍后,溶液的PH=b,則a>b | |
| D. | 1.0×10-3mol/L鹽酸的PH=3.0,1.0×10-8mol/L鹽酸PH=8.0 |
分析 A.根據酸堿混合及溶液的pH=7來分析NaOH溶液的pH;
B.根據離子對氨水的電離平衡的影響來分析平衡移動及溶液的pH;
C.根據弱電解質的電離平衡來分析稀釋后的pH;
D.根據常溫下酸溶液的pH一定小于7來分析.
解答 解:A.因酸堿混合后pH=7,即恰好完全反應,設堿的濃度為c,則1×0.1mol/L=100×c,c=0.001mol/L,則NaOH溶液的pH=11,故A正確;
B.在氨水中存在電離平衡,當加入NH4Cl,平衡逆向移動,氫氧根離子的濃度減小,由酚酞的變色范圍8.2~10可知,此時溶液的pH可能小于8.2,不一定小于7,故B錯誤;
C.因醋酸是弱電解質,稀釋時促進電離,但氫離子的濃度減小,則pH變大,即b>a,故C錯誤;
D.因常溫下,中性溶液的pH=7,則酸的pH一定小于7,即鹽酸溶液的pH不會為8,故D錯誤;
故選A.
點評 本題考查了電離平衡及pH的有關計算,學生應注意酸的溶液的pH在常溫下一定小于7,能利用影響平衡的因素及酸堿反應的實質來分析解答即可,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 鎂原子的核電荷數為12 | |
| B. | 鎂原子的相對原子質量為24.31g | |
| C. | 鎂屬于非金屬元素 | |
| D. | 在化學反應中,鎂原子容易得到電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生石灰、無水硫酸銅 | B. | 無水硫酸銅、濃硫酸 | ||
| C. | 無水硫酸銅、生石灰 | D. | 金屬鈉、生石灰 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 觀察K2SO4溶液的顏色 | |
| B. | 向CuSO4溶液中滴加適量的NaOH溶液,振蕩后靜置,溶液顏色消失 | |
| C. | 加水稀釋后CuSO4溶液顏色變淺 | |
| D. | 向CuSO4溶液中滴加適量的Ba(NO3)2溶液,振蕩后靜置,溶液顏色未消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
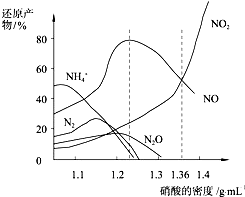
| A. | 密度小于1.1g/mL的硝酸與金屬反應,還原產物主要是NH4+ | |
| B. | 當硝酸溶液的密度為1.36g/mL時,Fe與過量硝酸反應的化學方程式為:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸與金屬反應,一定被還原成NO | |
| D. | 某硝酸試劑瓶的標簽注明:密度1.26g/mL,質量分數50.0%;若取該試劑10mL配成1000mL溶液,所得溶液的物質的量濃度為1 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 油脂發生皂化反應能生成甘油 | |
| B. | 蔗糖水解前后均可發生銀鏡反應 | |
| C. | Fe、Cu、Ag三種金屬常用化學還原劑還原法制得 | |
| D. | 向蛋白質溶液中加入CuSO4溶液發生鹽析 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com