
分析 (1)固體的質量增加了2.80g為Si3N4的質量,根據n=$\frac{m}{M}$計算其物質的量,根據方程式計算消耗氫氣的物質的量,再根據v=$\frac{\frac{△n}{V}}{△t}$計算v(H2);
平衡常數為生成物濃度化學計量數次數冪之積與生成物濃度化學計量數次數冪之積的比值;
(2)a.平衡常數只受溫度影響;
b.正反應為放熱反應,升高溫度平衡向逆反應方向移動,平衡常數減小;
c.Si3N4是固體,增大其物質的量,不影響平衡移動;
d.增大HCl物質的量,平衡向消耗HCl的方向移動;
(3)a.根據速率之比對化學計量數之比,可以確定v正(H2)=v逆(H2);
b.都表示正反應速率,反應自始至終都成立;
c.混合氣體密度保持不變說明混合氣體的總質量不變,而平衡移動則氣體的質量發生變化;
d.平衡時濃度關系與起始濃度有關、與轉化率有關;
(4)該反應正反應是放熱反應,降低溫度,平衡向正反應移動,到達新平衡,H2的物質的量減小,HCl的物質的量物質的量增大.
解答 解:(1)固體的質量增加了2.80g為Si3N4的質量,其物質的量$\frac{2.8g}{140g/mol}$=0.02mol,根據方程式可知消耗氫氣的物質的量=0.02mol×6=0.12mol,故v(H2)=$\frac{\frac{0.12mol}{2L}}{3min}$=0.02mol/(L.min);
平衡常數為生成物濃度化學計量數次數冪之積與生成物濃度化學計量數次數冪之積的比值,故該反應平衡常數K=$\frac{{c}^{12}(HCl)}{{c}^{3}(SiC{l}_{4})•{c}^{2}({N}_{2})•{c}^{6}({H}_{2})}$,
故答案為:0.02;$\frac{{c}^{12}(HCl)}{{c}^{3}(SiC{l}_{4})•{c}^{2}({N}_{2})•{c}^{6}({H}_{2})}$;
(2)a.平衡常數只受溫度影響,壓強增大,平衡常數K不變,故a錯誤;
b.正反應為放熱反應,升高溫度平衡向逆反應方向移動,平衡常數減小,故b正確;
c.Si3N4是固體,增大其物質的量,不影響平衡移動,故c錯誤;
d.增大HCl物質的量,平衡向消耗HCl的方向移動,即向逆反應方向移動,故d正確,
故答案為:bd;
(3)a.根據速率之比對化學計量數之比,可以確定v正(H2)=v逆(H2),說明反應到達平衡狀態,故a正確;
b.都表示正反應速率,反應自始至終都成立,不能說明到達平衡狀態,故b錯誤;
c.混合氣體密度保持不變說明混合氣體的總質量不變,而平衡移動則氣體的質量發生變化,可以說明到達平衡狀態,故c正確;
d.平衡時濃度關系與起始濃度有關、與轉化率有關,不能說明到達平衡狀態,故D錯誤,
故答案為:ac;
(4)該反應正反應是放熱反應,降低溫度,平衡向正反應移動,到達新平衡,H2的物質的量減小,HCl的物質的量物質的量增大,新平衡H2和HCl的物質的量之比<$\frac{m}{n}$,
故答案為:<.
點評 本題考查化學反應速率計算、平衡狀態判斷、化學平衡移動等,意在考查學生的思維能力和分析推理能力,難度中等.


科目:高中化學 來源: 題型:解答題
 乙醛在氧化銅催化劑存在的條件下,可以被空氣氧化成乙酸.依據此原理設計實驗制得并在試管C中收集到少量乙酸溶液(如圖所示:試管A中裝有40%的乙醛水溶液、氧化銅粉末;試管C中裝有適量蒸餾水;燒杯B中裝有某液體).已知在60℃~80℃時用雙連打氣球鼓入空氣即可發生乙醛的氧化反應,連續鼓入十幾次反應基本完全.有關物質的沸點見下表:
乙醛在氧化銅催化劑存在的條件下,可以被空氣氧化成乙酸.依據此原理設計實驗制得并在試管C中收集到少量乙酸溶液(如圖所示:試管A中裝有40%的乙醛水溶液、氧化銅粉末;試管C中裝有適量蒸餾水;燒杯B中裝有某液體).已知在60℃~80℃時用雙連打氣球鼓入空氣即可發生乙醛的氧化反應,連續鼓入十幾次反應基本完全.有關物質的沸點見下表:| 物質 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸點 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;B→C的反應類型是取代反應.
;B→C的反應類型是取代反應. $→_{△}^{濃硫酸}$
$→_{△}^{濃硫酸}$ +nH2O.
+nH2O. 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若1mL PH=1鹽酸與100mL MaOH溶液混合后,溶液PH=7,則NaOH溶液的PH=11 | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好無色,則此時溶液的PH<7 | |
| C. | 某醋酸溶液的PH=a,將此溶液稀釋1倍后,溶液的PH=b,則a>b | |
| D. | 1.0×10-3mol/L鹽酸的PH=3.0,1.0×10-8mol/L鹽酸PH=8.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  表示KNO3的溶解度曲線,a點所示的溶液是80℃時KNO3不飽和溶液 | |
| B. |  表示某放熱反應分別在有、無催化劑的情況下反應過程中的能量變化 | |
| C. |  表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲線 | |
| D. |  表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,體積V與沉淀n的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
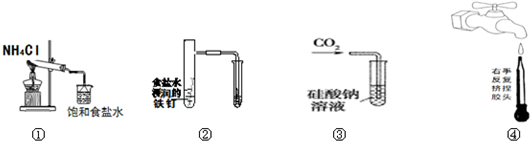
| A. | 實驗①制取的氨氣溶解在飽和NaCl溶液 | |
| B. | 實驗②通過觀察右邊試管有無倒吸現象說明鐵釘是否發生吸氧腐蝕 | |
| C. | 實驗③可用于證明碳的非金屬性比硅強 | |
| D. | 圖④是實驗室洗滌膠頭滴管的操作 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com