
分析 (1)分別計算鉀、硝酸鉀的物質的量,結合方程式計算;
(2)K2O2中K2O2和氧的質量比110:32;
(3)13.2L(標準狀況)CO2和KO2反應后,氣體體積變為18.8L,可結合方程式,利用差量法計算;
(4)設A的平均化學式為 KxOy,根據反應KxOy+$\frac{x}{2}$CO2═$\frac{x}{2}$K2CO3+(y-0.5x)O2進行計算.
解答 解:(1)n(K)=$\frac{39g}{39g/mol}$=1mol,n(KNO3)=$\frac{10.1g}{101g/mol}$=0.1mol,由方程式10K+2KNO3→6K2O+N2可知,K過量,硝酸鉀完全反應,則應生成0.3molK2O,
質量為:0.3mol×94g/mol=28.2g,
故答案為:28.2;
(2)K2O2中K2O2和氧的質量比110:32,某過氧化鉀樣品中氧的質量分數(雜質不含氧)為0.28,則樣品中K2O2的質量分數為0.28×$\frac{110}{32}$×100%=96.25%,
故答案為:96.25%;
(3)4KO2+2CO2→2K2CO3+3O2 △V
4mol 4.8L 67.2L 22.4L
n 5.6L
n=$\frac{4mol×5.6L}{22.4L}$=1mol,
m(KO2)=1mol×71g/mol=71g,
答:反應消耗的KO2的質量為71g;
(4)設A的平均化學式為 KxOy,
KxOy+$\frac{x}{2}$CO2═$\frac{x}{2}$K2CO3+$\frac{1}{2}$(y-0.5x)O2
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x:y=2:3,
即:n(K):n(O)=2:3.
產物A中鉀氧兩種原子個數之比2:3,
答:A中鉀氧兩種原子個數之比為2:3.
點評 本題考查氧化還原反應,為高考常見題型,側重氧化還原反應中基本概念的考查,明確含元素化合價降低的物質為氧化劑、還原劑被氧化等即可解答,題目較簡單.


科目:高中化學 來源: 題型:解答題
 某同學用下列裝置(固定、加熱儀器和橡膠管略)進行有關氨氣制取的實驗探究,回答下列問題.
某同學用下列裝置(固定、加熱儀器和橡膠管略)進行有關氨氣制取的實驗探究,回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;
; ;
; 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6 g Fe 和足量的HCl完全反應失去電子數為0.3 NA | |
| B. | 22.4L O2含有NA個O2分子 | |
| C. | 0.2 mol/L CaCl2溶液中含有Clˉ離子的數目為0.4NA | |
| D. | 1.6g CH4所含的電子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 起始濃度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,用pH試紙測得某新制氯水的pH值為9 | |
| B. | 用標準鹽酸溶液滴定一定體積的待測NaOH溶液時,用石蕊做指示劑 | |
| C. | 用堿式滴定管量取高錳酸鉀溶液5.10 mL | |
| D. | 用10 mL的量筒量取8.5 mL濃硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
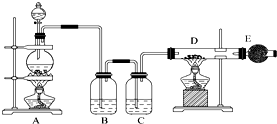 吸收尾氣中未反應的氯氣和防止空氣中水蒸氣進入裝置D.
吸收尾氣中未反應的氯氣和防止空氣中水蒸氣進入裝置D.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉和冷水反應:Na2O2+H2O═2Na++2OH-+H2↑ | |
| B. | 鋁粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 碳酸鈣溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亞鐵溶液中通入氯氣:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


 .
. .
. .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com