
分析 (1)雙氧水體現氧化性說明雙氧水中元素化合價僅降低,既體現氧化性又體現還原性說明雙氧水中元素化合價既升高又降低;
(2)氧化劑的氧化性>氧化產物的氧化性>還原劑的氧化性;
(3)①根據氧化還原反應中氧化劑和還原劑的特點和性質來尋找反應物和生成物,然后結合化合價升降相等配平;
②根據所發生的反應來分析化合價的變化情況,進而得到轉移電子的數目.
解答 解:(1)D中雙氧水中氧元素化合價僅降低,說明僅體現氧化性,C中雙氧水中氧元素化合價化合價既升高又降低,則既體現氧化性又體現還原性,故答案為:D;C;
(2)反應Ag2O+H2O2=2Ag+O2↑+H2O中,氧化銀做氧化劑,雙氧水作還原劑,則氧化性Ag2O>H2O2,反應3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,雙氧水做氧化劑,鉻酸鉀做氧化產物,則氧化性H2O2>K2CrO4,故氧化性順序為:Ag2O>H2O2>K2CrO4,
故答案為:Ag2O>H2O2>K2CrO4;
(3)①該反應過程中,高錳酸根的氧化性和雙氧水的還原性導致二者間發生氧化還原反應,高錳酸根離子中錳元素從+7變為+2價,化合價降低5價,雙氧水中氧元素化合價從-1價變為0價,化合價至少升高2價,則高錳酸根離子的系數為2,雙氧水的系數為5,然后利用質量守恒配平可得該反應的離子方程式為:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案為:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
②上述反應中生成5mol氧氣轉移電子10mol,當反應中有6.72L(標準狀況)即0.3mol氧氣生成時,則轉移的電子為:10mol×$\frac{0.3mol}{5}$=0.6mol,
故答案為:0.6.
點評 本題考查了氧化還原反應的配平及綜合應用,題目難度中等,試題知識點較多、綜合性較強,充分考查學生的分析、理解能力及靈活應用能力,注意掌握氧化還原反應的配平方法,明確氧化劑、還原劑的概念及判斷方法.


 新輔教導學系列答案
新輔教導學系列答案 陽光同學一線名師全優好卷系列答案
陽光同學一線名師全優好卷系列答案科目:高中化學 來源: 題型:解答題
 甲醇是一種可再生能源,具有廣泛的開發和應用前景.
甲醇是一種可再生能源,具有廣泛的開發和應用前景.| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(B2-)+c(HB-)=0.1 mol/L | B. | c(B2-)+c(HB-)+c(H2B)=0.1 mol/L | ||
| C. | c(OH-)=c(H+)+c(HB-)+2c(H2B) | D. | c(Na+)+c(OH-)=c(H+)+c(HB-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
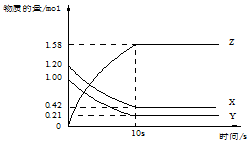 一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示:下列描述正確的是( )
一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示:下列描述正確的是( )| A. | 反應開始到10s,用Z表示的反應速率為0.158mol/(L•s) | |
| B. | 反應開始到10s,X的物質的量濃度減少了0.79mol/L | |
| C. | 反應的化學方程式為:X(g)+Y(g)?Z(g) | |
| D. | 反應開始到10s時,Y的轉化率為79.0% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
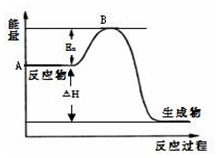 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反應過程的能量變化如圖所示.已知1mol SO2(g)完全轉化為1mol SO3(g)放熱99kJ.請回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反應過程的能量變化如圖所示.已知1mol SO2(g)完全轉化為1mol SO3(g)放熱99kJ.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com