
| A. | 離子半徑大小:F->Na+>Mg2+ | B. | 金屬性強弱:K>Mg>Ca | ||
| C. | 酸性強弱:HIO4>HBrO4>HClO4 | D. | 堿性強弱:LiOH>NaOH>KOH? |
分析 A.核外電子排布相同時,原子序數越大,半徑越小;
B.同主族,原子序數越大,金屬性越強,同周期,原子序數越小,金屬性越強;
C.元素的非金屬性越強,對應的最高價氧化物的水化物的酸性越強;
D.金屬性越強,對應的最高價氧化物的水化物的堿性越強.
解答 解:A.核外電子排布相同時,原子序數越大,離子半徑越小,則離子半徑:Mg2+<Na+<F-,即F->Na+>Mg2+,故A正確;
B.Mg與Ca處于同一主族,金屬性Ca>Mg,故金屬性強弱為:K>Ca>Mg,故B錯誤;
C.元素的非金屬性Cl>Br>I,對應的最高價氧化物的水化物的酸性HClO4>HBrO4>HIO4,故C錯誤;
D.金屬性越強,對應的最高價氧化物的水化物的堿性越強,由于金屬性K>Na>Li,故堿性KOH>NaOH>LiOH,故D錯誤;
故選A.
點評 本題考查元素周期律知識,側重于學生的分析能力和基本概念的理解和運用的考查,注意元素的性質與對應單質、化合物的關系,把握元素周期律的遞變規律是解答該類題目的關鍵,難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 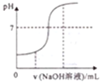 向酸性溶液中滴加NaOH溶液時pH隨NaOH溶液體積變化關系 | |
| B. |  某反應為放熱反應,催化劑能改變反應的焓變 | |
| C. |  不同溫度下,水溶液中c(H+)與c(OH-)變化關系 | |
| D. | 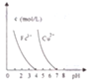 pH=7時,Cu2+、Fe3+都能沉淀完全 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入NaOH的乙醇溶液,加熱后加入AgNO3溶液 | |
| B. | 加入NaOH溶液加熱,冷卻后加入稀硝酸酸化,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸餾水,充分攪拌后,加入AgNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
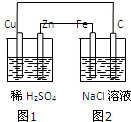
| A. | 裝置中圖1為原電池,圖2為電解池 | |
| B. | 圖2中Fe電極上的電極反應式為:2C1--2e一═C12↑ | |
| C. | 圖1、圖2溶液中的H+分別向Cu、Fe電極移動 | |
| D. | 該裝置工作一段時間后,圖1、圖2溶液的pH均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只存在于CO2中 | B. | 只存在于CO中 | ||
| C. | 存在于CO2和H2O中 | D. | 存在于CO、H2O和CO2中 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com