
| A. | 用銅作電極電解NaCl溶液,可以實現反應:Cu+2H2O$\frac{\underline{\;電解\;}}{\;}$Cu(OH)2↓+H2↑ | |
| B. | 用銅、鋁作電極與電解質溶液構成原電池時,銅一定是正極 | |
| C. | N2O4和NO2混合氣體69g,完全與水反應轉移電子數約為6.02×1023 | |
| D. | HCl和HS-均是含有一個極性鍵的18電子粒子 |
分析 A.Cu在陽極失電子生成銅離子,水電離的氫離子在陰極得電子生成氫氣;
B.銅、鋁作電極,濃硝酸作電解質溶液時,Al會鈍化;
C.N2O4和NO2混合氣體中N2O4能轉化為NO2,結合反應3NO2+H2O=2HNO3+NO分析計算;
D.不同非金屬原子間形成極性鍵,結合微粒的電子數分析.
解答 解:A.Cu在陽極失電子生成銅離子,水電離的氫離子在陰極得電子生成氫氣,溶液中銅離子與氫氧根離子結合生成氫氧化銅沉淀,則用銅作電極電解NaCl溶液,可以實現反應:Cu+2H2O$\frac{\underline{\;電解\;}}{\;}$Cu(OH)2↓+H2↑,故A正確;
B.銅、鋁作電極,濃硝酸作電解質溶液時,Al會鈍化,Cu失電子,Cu作負極,Al為正極,正極上硝酸根離子得電子,故B錯誤;
C.N2O4和NO2混合氣體中N2O4能轉化為NO2,69g全部轉化為NO2時,其物質的量為1.5mol,反應3NO2+H2O=2HNO3+NO中3mol氣體轉移2mol電子,所以1.5mol氣體轉移1mol電子,即轉移電子數約為6.02×1023,故C正確;
D.不同非金屬原子間形成極性鍵,HCl中含有H-Cl極性鍵,HS-中含有H-S極性鍵,二者含有18電子,故D正確.
故選B.
點評 本題考查了電解原理的應用、原電池原理的應用、氧化還原反應、化學鍵等,題目涉及的知識點較多,題目難度中等,注意把握四氧化二氮與二氧化氮的轉化以及氧化還原反應中電子轉移的計算,側重于考查學生的分析能力和計算能力.


科目:高中化學 來源: 題型:解答題
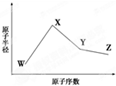 W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如下圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的電負性在同周期主族元素中最大.
W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如下圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的電負性在同周期主族元素中最大.| 化學鍵 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 鍵能/ kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 過氧化氫酶在重金屬鹽的作用下會失去活性 | |
| B. | 油脂的硬化是指含有不飽和鍵的油脂發生的催化加氫的反應 | |
| C. | 即使條件不同,鹵代烷烴與強堿反應生成的有機物也都只有一種 | |
| D. | 有機物都是由碳、氫和氧三種元素組成的,含有碳元素的物質都是有機物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2個 | B. | 3個 | C. | 4個 | D. | 5個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質、淀粉、纖維素、葡萄糖等都能在人體內水解并提供能量 | |
| B. | 將甲烷和乙烯的混合氣體通過盛有溴水的洗氣瓶,即可提純甲烷 | |
| C. | C2H6與氯氣發生取代反應,C2H4與HCl發生加成反應,均可得到C2H5Cl | |
| D. | 用溴水一種試劑就可將苯、CCl4、乙酸、乙醇區別 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2、I2、HI平衡時的混合氣體加壓后顏色變深 | |
| B. | Na2CrO4溶液中滴加稀硫酸,溶液顏色變深 | |
| C. | 紅棕色的NO2加壓后顏色先變深后逐漸變淺 | |
| D. | 向氯水中加入適量石灰石,氯水的殺菌能力增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 改變汽車尾氣排放壓強 | |
| B. | 提高反應溫度 | |
| C. | 在尾氣排放處使用催化劑 | |
| D. | 向汽車發動機燃燒室中通入過量的空氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①② | C. | ②③④ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com