
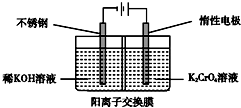
| A. | 在陰極室,發生的電極反應為2H2O+2e-═2OH-+H2↑ | |
| B. | 在陽極室,通電后溶液逐漸由黃色變為橙色,是因為陽極區H+濃度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移動 | |
| C. | 該制備過程中總反應的化學方程式為4K2CrO4+4H2O$\frac{\underline{\;通電\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 測定陽極液中K和Cr的含量,若K與Cr的物質的量之比(nK/nCr)為d,則此時鉻酸鉀的轉化率為1 |
分析 A、陰極上得電子發生還原反應;
B、陽極上水失電子生成氧氣和氫離子,氫離子濃度增大導致平衡移動,根據氫離子濃度的變化判斷溶液顏色的變化;
C、電解時,鉻酸鉀和水放電生成重鉻酸鉀、氫氣、氧氣和氫氧化鈉;
D、根據原子守恒計算其轉化率.
解答 解:A、根據題意可知:電極均為惰性電極,在陰極室,水得電子變成氫氣,電極反應為:2H2O+2e-=2OH-+H2↑,故A正確;
B、陽極室水失去電子,電極反應為:2H2O-4e-=4H++O2↑,使陽極區氫離子濃度增大,平衡右移,故B正確;
C、總制備方程式為4K2CrO4 +4H2O $\frac{\underline{\;通電\;}}{\;}$2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正確;
D、設加入反應容器內的K2CrO4為1mol,反應過程中有xmol K2CrO4轉化為K2Cr2O7,則陽極區剩余K2CrO4為(1-x)mol,對應的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7為$\frac{x}{2}$mol,對應的n(K)=xmol,n(Cr)=xmol,根據:K與Cr的物質的量之比為d,解得x=2-d,轉化率為$\frac{2-d}{1}$=2-d,故D錯誤;
故選D.
點評 本題考查了電解原理,難點是計算轉化率,根據原子守恒即可計算其轉化率,根據陰陽極上發生的反應類型寫出相應的電極反應式.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:選擇題
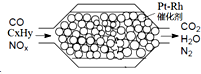 汽車尾氣含氮氧化物(NOX)、碳氫化合物(CXHY)、碳等,直接排放容易造成“霧霾”.因此,不少汽車都安裝尾氣凈化裝置(凈化處理過程如圖).下列有關敘述,錯誤的是( )
汽車尾氣含氮氧化物(NOX)、碳氫化合物(CXHY)、碳等,直接排放容易造成“霧霾”.因此,不少汽車都安裝尾氣凈化裝置(凈化處理過程如圖).下列有關敘述,錯誤的是( )| A. | 尾氣造成“霧霾”與汽油未充分燃燒有關 | |
| B. | 尾氣處理過程,氮氧化物(NOX)被還原 | |
| C. | Pt-Rh催化劑可提高尾氣凈化反應的平衡轉化率 | |
| D. | 使用氫氧燃料電池作汽車動力能有效控制霧霾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
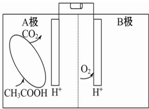
| A. | A極為正極,B極為負極 | |
| B. | 電池內電解質溶液中所含的H+由B極移向A極 | |
| C. | A極的電極反應為:CH3COOH-8e-+2H2O═2CO2↑+8H+ | |
| D. | 電池工作過程中,電解質溶液的pH會明顯下降 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 用圖1示裝置制備Cl2 | |
| B. | 將混合氣體通過裝有NaOH溶液的洗氣瓶除去Cl2中混有的HCl | |
| C. | 用圖2示裝置分離CH3COOC2H5與飽和Na2CO3溶液 | |
| D. | 稱取1.06 g Na2CO3固體,置于100 mL容量瓶中,加水稀釋,配制0.10 mol•L-1的Na2CO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

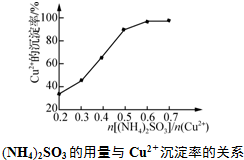 ,工業上$\frac{n[(N{H}_{4})_{2}S{O}_{3}]}{n(C{u}^{2+})}$采用0.6最為適宜,此時(NH4)2SO3略過量,其原因是保證生成的CuCl不被氧氣氧化或(NH4)2SO3被空氣中的氧氣氧化.
,工業上$\frac{n[(N{H}_{4})_{2}S{O}_{3}]}{n(C{u}^{2+})}$采用0.6最為適宜,此時(NH4)2SO3略過量,其原因是保證生成的CuCl不被氧氣氧化或(NH4)2SO3被空氣中的氧氣氧化.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2L苯中含有C-H鍵的數目為3NA | |
| B. | 常溫下,1.0L pH=13的Ba(OH)2溶液中含有的OH-數目為0.1NA | |
| C. | 常溫下,56g鐵片投入足量濃H2SO4中生成NA個SO2分子 | |
| D. | 標準狀況下22.4LSO3中含有的氧原子數目為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 A1/MnO4-電池是一種高能電池,以Ga2O3為緩蝕劑,其示意圖如圖所示.已知電池總反應為Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列說法正確的是( )
A1/MnO4-電池是一種高能電池,以Ga2O3為緩蝕劑,其示意圖如圖所示.已知電池總反應為Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列說法正確的是( )| A. | 電池工作時,K+向負極移動 | |
| B. | 電池工作時,Al電極周圍溶液pH增大 | |
| C. | 正極反應為MnO4-+2H2O+3e-═MnO2+4OH- | |
| D. | 電池工作時,電子由Al經溶液流向Ni |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N2(CO):通過灼熱的CuO粉末 | B. | Na2SO4溶液(Na2CO3):加鹽酸 | ||
| C. | NaCl(NH4Cl):加熱 | D. | NO2(NO):通入水中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
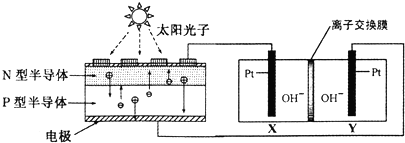
| A. | 圖中N型半導體為正極,P型半導體為負極 | |
| B. | 圖中離子交換膜為陽離子交換膜 | |
| C. | 反應完畢,該裝置中電解質溶液的堿性增強 | |
| D. | 人體呼出的氣體參與X電極的反應:CO2+2e一+H2O═CO+2OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com