
| A. | 在化工生產中應遵循“綠色化學”的思想 | |
| B. | 在元素周期表的過渡元素中尋找優良的催化劑 | |
| C. | 汽車尾氣中產生NO的原因是空氣中的N2與O2在汽車汽缸內的高溫環境下發生反應的產物 | |
| D. | 根據元素周期律,由HClO4可以類推出氟元素也存在最高價氧化物的水化物HFO4 |
分析 A.綠色化學又稱環境友好化學,有利于環境保護和資源充分利用;
B.過渡元素均為金屬元素;
C.汽車缸內的高溫環境下,空氣中氮氣和氧氣在火花塞電打火條件下反應生成一氧化氮;
D.氟元素無正價,也就是無最高價氧化物的水化物.
解答 解:A.在化工生產中應遵循“綠色化學”的思想有利于環境保護和資源充分利用,故A正確;
B.過渡元素均為金屬元素,則在過渡元素中尋找優良的催化劑,故B正確;
C.汽車缸內在電火花條件下氮氣和氧氣反應生成一氧化氮氣體,故C正確;
D.氟元素無正價,也就是無最高價氧化物的水化物,故D錯誤;
故選:D.
點評 本題考查了綠色化學概念的理解及元素周期律的應用,熟悉綠色化學的核心及元素周期律內容是解題關鍵,題目難度不大.


 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:解答題
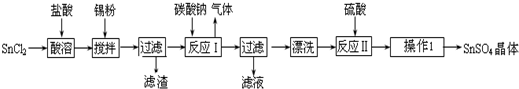
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
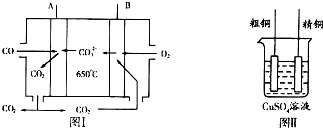
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 操作和現象 | 結 論 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的試管中,先滴幾滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.試管中先出現白色沉淀,后出現淡黃色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向裝有Fe(NO3)2溶液的試管中加入幾滴稀H2SO4溶液顏色基本不變 | Fe(NO3)2與H2SO4不反應 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振蕩,分層,下層溶液呈紫色 | CCl4可作為碘的萃取劑 |
| D | 測定飽和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
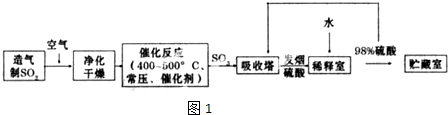
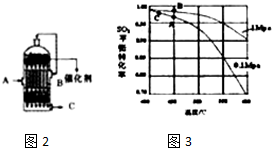
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
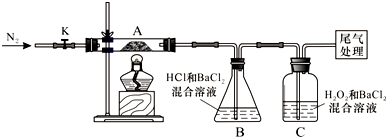
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
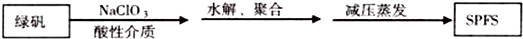
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中,K+、Ca2+、Cl2、Br -可以大量共存 | |
| B. | 與足量Ca( OH)2溶液反應的離子方程式:Ca2++OH-+HS03═CaS03↓+H20 | |
| C. | 與FeCI3溶液反應的離子方程式:SO32-+2 Fe3++H20═SO42-+2Fe2++2H+ | |
| D. | 能使含I2的淀粉溶液藍色褪去,說明NaHSO3溶液具有漂白性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
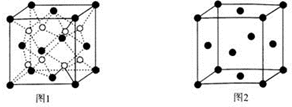
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com